Журнал "Гастроэнтерология" Том 58, №2, 2024
Вернуться к номеру
Ультразвукові критерії оцінки корекції метаболічно-асоційованої стеатотичної хвороби печінки і порушень печінкового кровотоку за допомогою аргініну у хворих на ішемічну хворобу серця в поєднанні з коронавірусною хворобою
Авторы: Мостовий С.Є. (1, 2), Жайворонок М.М. (2, 3), Сафонова О.M. (4)
(1) - Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
(2) - Медичний центр «Медбуд», м. Київ, Україна
(3) - Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
(4) - КНП «Київська міська клінічна лікарня № 18», м. Київ, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
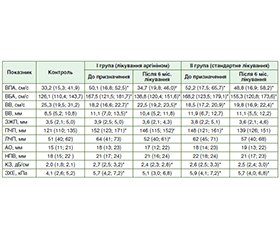
Актуальність. Коронавірусна хвороба 2019 року (COVID-19) лишається на сьогодні однією з найактуальніших глобальних проблем охорони здоров’я. В умовах поширення COVID-19 по всьому світу світова наукова спільнота намагається вивчати не лише респіраторні, але й позалегеневі прояви цієї інфекції. Відомо, що при COVID-19 уражаються ендотелій, система гемостазу і печінка з виникненням такого ускладнення, як метаболічно-асоційована стеатотична хвороба печінки (МАСХП). Найбільш уразливою групою хворих на коронавірусну хворобу та її ускладнення (у тому числі МАСХП) є пацієнти з ішемічною хворобою серця (ІХС), тому пошук ефективних препаратів і оптимальних критеріїв ультразвукової оцінки стеатозу печінки в динаміці лікування є основним завданням сучасної медицини. Мета: визначити ультразвукові критерії оцінки корекції МАСХП і порушень печінкового кровотоку за допомогою аргініну у хворих на ІХС у поєднанні з COVID-19. Матеріали та методи. Проведено проспективне дослідження 52 хворих на ІХС, ПЛР-позитивних щодо COVID-19. Дослідження проводили при надходженні до стаціонару і через 6 міс. після виписки. І група (n = 27) — хворі на ІХС + COVID-19, які додатково до стандартної терапії при МАСХП отримували аргінін протягом 6 міс. після виписки зі стаціонару; ІІ (група порівняння, n = 25) — пацієнти, які отримували стандартну терапію без аргініну. Результати. Дуплексне сканування спланхнічних артерій на момент включення в дослідження показало, що у 21 (78,0 %) пацієнта у групі І і 19 (76,0 %) — у групі ІІ було відзначено зниження пікової систолічної швидкості кровотоку у власній печінковій артерії (ВПА), збільшення швидкості кровотоку у ворітній вені (ВВ) на початку лікування, а також збільшення розмірів печінки у 20 (74,0 %) хворих І групи і 17 (68,0 %) хворих ІІ групи. Було виявлено збільшення коефіцієнта згасання (КЗ) у всіх пацієнтів І і ІІ групи. Відмінностей між групами на момент включення в дослідження за показниками спланхнічного кровотоку і КЗ не виявлено. Через 6 міс. лікування аргініном у І групі відзначено поліпшення показників кровотоку у ВВ і зменшення швидкості кровотоку у ВПА, також відзначено зменшення діаметра ВВ, розмірів правої та лівої частки печінки, у ІІ групі поліпшення не виявлено. Повторне дослідження виявило зменшення КЗ у І групі. У пацієнтів групи II змін КЗ не виявлено. На початку дослідження було виявлено прямий зв’язок між фібриногеном і КЗ у пацієнтів І групи (r = 0,54; p < 0,05), а також (r = 0,51; p < 0,05) у хворих ІІ групи. Через 6 міс. концентрація С-реактивного білка знизилася в обох групах. Висновки. У хворих на ІХС у поєднанні з COVID-19 за наявності МАСХП було виявлено зниження кровотоку у ВВ, збільшення пікової систолічної швидкості (ПСШ) у ВПА. При використанні аргініну впродовж 6 міс. у поєднанні зі стандартною терапією згідно з протоколами Європейської асоціації кардіологів відзначено вірогідне зниження КЗ, ПСШ у ВПА, а також збільшення кровотоку у ВВ. Це вказує на можливість використання КЗ як основного маркера, а ПСШ у власній печінковій артерії та кровотоку у ВВ — як додаткових критеріїв ультразвукової оцінки корекції метаболічно-асоційованої стеатотичної хвороби печінки за допомогою аргініну у хворих на ІХС у поєднанні з COVID-19.
Background. Coronavirus disease 2019 (COVID-19) remains one of the most urgent global health problems today. In the conditions of its spread around the world, the global scientific community is trying to study not only respiratory, but also extrapulmonary manifestations of this infection. It is known that with COVID-19, the endothelium, the hemostasis system, and the liver are affected with the occurrence of such a complication as metabolic dysfunction-associated steatotic liver disease (MASLD). The most vulnerable group of patients in terms of coronavirus disease and its complications (including MASLD) are those with coronary heart disease (CAD), therefore the search for effective drugs and optimal ultrasound criteria to evaluate liver steatosis in the dynamics of treatment is the main task of modern medicine. Goal: to determine the ultrasound criteria for assessing the correction of MASLD and liver blood flow disorders using arginine in patients with CAD associated with COVID-19. Materials and methods. A prospective study was conducted in 52 patients with CAD combined with PCR-positive COVID-19. The study was carried out upon admission to the hospital and 6 months after discharge. Group I (n = 27) consisted of CAD + COVID-19 patients who, in addition to standard therapy for MASLD, received arginine for 6 months after discharge from the hospital; group II (comparison group, n = 25) included participants who received standard therapy without arginine. Results. Splanchnic artery duplex scanning at baseline showed that 21 (78.0 %) patients in group I and 19 (76.0 %) in group II had a decrease in peak systolic velocity (PSV) in the proper hepatic artery (PHA), an increase in portal vein blood flow at the beginning of treatment, as well as increased liver size in 20 (74.0 %) patients in group I and 17 (68.0 %) in group II. An increase in the attenuation coefficient was detected in all patients of groups I and II. There were no differences between the groups at the time of inclusion in the study in terms of splanchnic blood flow and attenuation coefficient. After 6 months of arginine treatment, an improvement in the portal vein blood flow and a decrease in blood flow velocity in the PHA, a decrease in the diameter of the portal vein, a decrease in the size of the right and left liver lobes were found in group I, with no improvement in group II. A repeated study revealed a decrease in the attenuation coefficient in group I and no changes in group II. At the beginning of the study, a direct correlation was found between fibrinogen and the attenuation coefficient in group I (r = 0.54; p < 0.05), as well as in group II (r = 0.51; p < 0.05). After 6 months, C-reactive protein decreased in both groups. Conclusions. In patients with CAD combined with COVID-19 in the presence of MASLD, a decrease in the portal vein blood flow and an increase in PSV in the PHA were found. When arginine was used for 6 months in combination with standard therapy, according to the European Society of Cardiology protocols, there was a significant decrease in the attenuation coefficient, PSV in the PHA, and an increase in the portal vein blood flow. This indicates the possibility of using the attenuation coefficient as the main marker, and PSV in the PHA and the portal vein blood flow as additional criteria for ultrasound assessment of MASLD correction with arginine in patients with CAD combined with COVID-19.
ішемічна хвороба серця; COVID-19; метаболічно-асоційована стеатотична хвороба печінки; печінковий кровотік; коефіцієнт затухання
coronary artery disease; COVID-19; metabolic dysfunction-associated steatotic liver disease; hepatic blood flow; attenuation coefficient
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Ferraioli G, Soares Monteiro LB. Ultrasound-based techniques for the diagnosis of liver steatosis. World J Gastroenterol. 2019 Oct 28;25(40):6053-6062. Published online 2019 Oct 28. doi: 10.3748/wjg.v25.i40.6053.
- D’Ardes D, Boccatonda A, Cocco G, Fabiani S, Rossi I, Bucci M, Guagnano MT, Schiavone C, Cipollone F. Impaired coagulation, liver dysfunction and COVID-19: Discovering an intriguing relationship. World J Gastroenterol. 2022;28(11):1102-1112. PMID: 35431501. DOI: 10.3748/wjg. v28.i11.1102.
- Ali FEM, Abd El-Aziz MK, Ali ММ, Ghogar ОМ, Bakr AG. COVID-19 and hepatic injury: cellular and molecular mechanisms in diverse liver cells. World J Gastroenterol. 2023 Jan 21;29(3):425-449.Published online 2023 Jan 21. doi: 10.3748/wjg.v29.i3.425.
- Skrypnyk IM, Maslova GS, Shcherbak OV. Nonalcoholic steatohepatitis as a risk factor for the development and progression of coronary heart disease. Health of Ukraine. 2021;1(59):33-34.
- Mansour S, Marjieh R, Kluger Y, Gilshtein H, Khuri S. Post-COVID-19 Cholangiopathy: A Recent Indication for Liver Transplantation. Journal of Clinical Medicine Research. 2023;15(4):250-254. doi: https://doi.org/10.14740/jocmr4914.
- Hayden MR. Endothelial activation and dysfunction in metabolic syndrome, type 2 diabetes and coronavirus di–sease 2019. J Int Med Res. 2020;48(7):0300060520939746. doi: 10.1177/0300060520939746.
- Snider JM et al. Group IIA secreted phospholipase A2 is associated with the pathobiology leading to COVID-19 mortality. J Clin Invest. 2021 Oct 1;131(19):e149236. doi: 10.1172/JCI149236. Ето 6А.
- Hedenstierna G, Chen L, Hedenstierna M, Lieberman R, Fine DH. Nitric oxide dosed in short bursts at high concentrations may protect against Covid 19. Nitric Oxide. 2020;103:1-3. doi: 10.1016/j.niox.2020.06.005.
- Assumpção CR, Brunini TM, Pereira NR, Godoy-Matos AF, Siqueira MA, Mann GE, et al. Insulin resistance in obesity and metabolic syndrome: Is there a connection with platelet l-arginine transport? Blood Cells Mol Dis. 2011;45(4):338-342. doi: 10.1016/ j.bcmd.2010.10.003.
- Huang PL. eNOS, metabolic syndrome and cardiovascular disease. Trends Endocrinol Metab. 2009;20(6):295-302. doi: 10.1016/j.tem.2009.03.005.
- Mendrick DL, Diehl AM, Topor LS, Dietert RR, Will Y, La Merrill MA, et al. Metabolic syndrome and associated diseases: from the bench to the clinic. Toxicol Sci. 2018;162(1):36-42. doi: 10.1093/ toxsci/kfx233.
- Guimarães LMF, Rossini CVT, Lameu C. Implications of SARS-Cov-2 infection on eNOS and iNOS activity: Consequences for the respiratory and vascular systems. Nitric Oxide. 2021;111-112:64-71. doi: 10.1016/j.niox.2021.04.003.
- Hill MA, Mantzoros C, Sowers JR. Commentary: COVID-19 in patients with diabetes. Metabolism. 2020;107:154217. doi: 10.1016/j.metabol.2020.154217.
- Targher G, Byrne CD, Tilg H. MASLD: a systemic metabolic disorder with cardiovascular and malignant complications. Gut. 2024 Mar 7;73(4):691-702. doi: 10.1136/gutjnl-2023-330595. PMID: 38228377.
- Chan WK, Chuah KH, Rajaram RB, Lim LL, Ratnasingam J, Vethakkan SR. Metabolic Dysfunction-Associated Steatotic Liver Disease (MASLD): A State-of-the-Art Review. J Obes Metab Syndr. 2023 Sep 30;32(3):197-213. doi: 10.7570/jomes23052. Epub 2023 Sep 13. PMID: 37700494; PMCID: PMC10583766.
- Sasso M, Tengher-Barna I, Ziol M, Miette V, Fournier C, Sandrin L, et al. Novel controlled attenuation parameter for noninvasive assessment of steatosis using Fibroscan (R): Validation in chronic hepatitis C. J Viral Hepat. 2012;19(4):244-253. https://doi.org/10.1111/j.1365-2893.2011.01534.x.
- Balci А, Karazincir S, Sumbas Н, Oter Y, Egilmez Е, Inandi Т. Effects of diffuse fatty infiltration of the liver on portal vein flow hemodynamics. Journal of Clinical Ultrasound. 2008;36(4):134-140. https://doi.org/10.1002/jcu.20440.
- Hryshina RA. Non-alcoholic fatty liver disease. Vrachebnoe delo. 1985:87-88.
- Sabry M, Youssef T, Shaker M, et al. Portal venous and hepatic artery hemodynamic variation in non-alcoholic fatty liver di–sease. Egyptian Liver Journal. 2021;11(58). https://eglj.springeropen.com/articles/10.1186/s43066-021-00130-7.
- Besir E, Ali T, Ramazan B, et al. Portal vein hemodynamics in patients with non-alcoholic fatty liver disease. J Clin Diagn Res. 2016;10(8):TC07-TC10.
- Balasubramanian P, Boopathy V, Govindasamy E, et al. Assessment of portal venous and hepatic artery haemodynamic variation in non-alcoholic fatty liver disease (NAFLD) patients. J Clin Diagn Res. 2016;10(8):TC07-TC10.
- Ehsan S, Ghanaei FM, et al. Comparison of portal vein doppler indices and hepatic vein doppler waveform in patients with nonalcoholic fatty liver disease with healthy control. Hepat Mon. 2011;11(9):740-744. https://doi.org/10.5812/kowsar.1735143X.729.
- Dos Reis G, Monteiro ML, Ferreira DE, et al. Liver haemodynamic patterns in nonalcoholic steatosis: Doppler ultrasonography and histological evaluation. Gastroenterol Dietol. 2016;62(1):19-29.
- Claudio T, Marco T, Stefano R, et al. Hepatic artery resistive index (HARI) and non-alcoholic fatty liver disease (NAFLD) fibrosis score in NAFLD patients: cut-off suggestive of non-alcoholic steatohe–patitis (NASH) evolution. J Ultrasound. 2016;19(3):183-189.
- Kakumitsu S, Shijo H, Yokoyama М, Kim Т, Akiyoshi N, Ota К, et al. Effects of l-arginine on the systemic, mesenteric, and Hepatic circulation in patients with cirrhosis. First published: 30 December 2003. https://doi.org/10.1002/hep.510270210.
- Poeze М, Bruins MJ, Kessels F, Luiking YC, Lamers WH, Deutz NEP. Effects of L-arginine pretreatment on nitric oxide metabolism and hepatosplanchnic perfusion during porcine endotoxemia. Am J Clin Nutr. 2011 Jun;93(6):1237-1247. doi: 10.3945/ajcn.110.007237.
- Wu G, Bazer FW, Davis TA, Kim SW, Li Р, Rhoads JM et al. Arginine metabolism and nutrition in growth, health and disease. Amino Acids. 2009 May;37(1):153-168. doi: 10.1007/s00726-008-0210-y.
- Gambardella J, Khondkar W, Morelli MB, Wang Х, Santulli G, Trimarco V. Arginine and Endothelial Function. Biomedicines. 2020;8(8):277. https://doi.org/10.3390/biomedicines8080277.
- Akerström S, Gunalan V, Keng CT, Tan YJ, Mirazimi A. Dual effect of nitric oxide on SARS-CoV replication: Viral RNA production and palmitoylation of the S protein are affected. Virology. 2009;395: 1-9. doi: 10.1016/j.virol.2009.09.007.
- Diehl AM, Day C. Cause, Pathogenesis, and Treatment of Nonalcoholic Steatohepatitis. N Engl J Med. 2017 Nov 23;377(21):2063-2072. doi: 10.1056/NEJMra1503519.
- Simon TG, Wilechansky RM, Stoyanova S, et al. Aspirin for Metabolic Dysfunction–Associated Steatotic Liver Disease Without Cirrhosis. Jama. 2024; 331(11):920-929. doi: 10.1001/jama.2024.1215.
- An Y, Yun SJ, Yang I-H, Kim DH, Yang DM. Predictive Performance of Ultrasound-Determined Non-Alcoholic Fatty Pancreas Disease Severity for Intermediate and High Risk of Coronary Heart Disease. J Korean Soc Radiol. 2019;80(6):1190-1202. https://doi.org/10.3348/jksr.2019.80.6.1190. pISSN 1738-2637/eISSN 2288-2928.