Журнал "Гастроэнтерология" Том 58, №2, 2024
Вернуться к номеру
Синергічний вплив урсодезоксихолевої кислоти та кверцетину на функцію печінки й системне запалення в пацієнтів із неалкогольною жировою хворобою печінки і фібриляцією передсердь
Авторы: O.B. Teslenko, S.V. Fedorov, M.V. Bielinskyi, A.S. Herashchenko, N.B. Nyshchuk-Oliinyk
Ivano-Frankivsk National Medical University, Ivano-Frankivsk, Ukraine
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
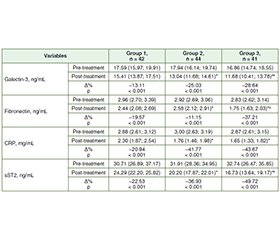
Актуальність. Поєднання неалкогольної жирової хвороби печінки (НАЖХП) та фібриляції передсердь (ФП) має значні клінічні наслідки, що зумовлює необхідність пошуку стратегій з урахуванням багатогранної природи обох станів. У цьому дослідженні ми оцінювали ефективність стандартної терапії порівняно з комбінованим лікуванням із використанням урсодезоксихолевої кислоти (УДХК) і кверцетину в пацієнтів із НАЖХП та ФП, фокусуючись на поліпшенні функції печінки, ліпідного профілю, маркерів системного запалення й фіброзу. Мета: оцінити й порівняти ефективність тільки стандартної терапії та стандартної терапії в поєднанні з урсодезоксихолевою кислотою з кверцетином і без нього в осіб із неалкогольною жировою хворобою печінки та супутньою фібриляцією передсердь. Матеріали та методи. Дослідження було проспективним рандомізованим контрольованим, включало 127 пацієнтів iз діагностованою НАЖХП та супутньою ФП, які були розподілені на три групи: група 1 — стандартна терапія (n = 42), група 2 — стандартне лікування плюс УДХК (n = 44) і група 3 — стандартне лікування плюс УДХК і кверцетин (n = 41). Ефективність оцінювали по змінах печінкових проб (аланінамінотрансфераза (АЛТ), аспартатамінотрансфераза (АСТ), гамма-глутамілтрансфераза, лужна фосфатаза), ліпідного профілю (загальний холестерин, холестерин ліпопротеїнів низької та високої щільності (ХС ЛПВЩ), тригліцериди) і неінвазивних показників фіброзу печінки (NFS, FIB-4). Також оцінювали вплив лікування на системні маркери запалення (С-реактивний білок, галектин-3, розчинний ST2) і рівень фібронектину. Результати. В усіх групах значно покращилися печінкові проби й ліпідний профіль. У групі 3 спостерігалося найсуттєвіше зниження АЛТ, АСТ та підвищення рівня ХС ЛПВЩ, що свідчить про посилення гепатопротекторних і ліпідомодулюючих ефектів. Маркери системного запалення та рівень фібронектину значно знизилися в групах, які отримували УДХК і кверцетин, причому найбільший ефект спостерігався в групі 3, що свідчить про виражену протизапальну й антифібротичну дію. Крім того, значне поліпшення показників NFS і FIB-4 у групі 3 підкреслює антифібротичний потенціал комбінації УДХК і кверцетину зі стандартним лікуванням. Висновки. Додавання УДХК та кверцетину до стандартної терапії в пацієнтів із НАЖХП і ФП значно покращує функцію печінки, ліпідний обмін, зменшує системне запалення й фіброз порівняно з одним лише стандартним лікуванням. Такі дані свідчать про синергічний ефект УДХК і кверцетину, що дозволяє запропонувати цей перспективний терапевтичний підхід при складному поєднанні НАЖХП і ФП.
Background. Non-alcoholic fatty liver disease (NAFLD) and atrial fibrillation (AF) co-occur with significant clinical implications, necessitating therapeutic strategies that address the multifaceted nature of these conditions. This study evaluated the efficacy of standard treatment alone versus combined treatments with ursodeoxycholic acid (UDCA) and quercetin in patients with NAFLD and AF, focusing on improvements in liver function, lipid profile, systemic inflammation, and fibrosis markers. Aim: to evaluate and compare the efficacy of standard treatment alone versus standard treatment combined with ursodeoxycholic acid with and without quercetin in patients with non-alcoholic fatty liver disease and concurrent atrial fibrillation. Materials and methods. In a prospective, randomized, controlled trial, 127 patients with diagnosed NAFLD and concurrent AF were enrolled. They were divided into three groups: group 1 — standard treatment (n = 42), group 2 — standard treatment plus UDCA (n = 44), and group 3 — standard treatment plus UDCA and quercetin (n = 41). The primary outcomes included changes in liver function tests (alanine aminotransferase (ALT), aspartate aminotransferase (AST), gamma-glutamyl transferase, alkaline phosphatase), lipid profile (total cholesterol, low- and high-density lipoprotein cholesterol (HDL-C), triglycerides), and non-invasive liver fibrosis scores (NFS, FIB-4). Secondary outcomes focused on systemic inflammation markers (C-reactive protein, galectin-3, soluble ST2) and fibronectin levels. Results. All treatment groups showed significant improvements in liver function tests and lipid profiles. Group 3 exhibited the most substantial reductions in ALT, AST, and improvements in HDL-C, indicating enhanced hepatoprotective and lipid-modulating effects. Systemic inflammation markers and fibronectin levels decreased significantly in groups receiving UDCA and quercetin, with the most pronounced effects observed in group 3, suggesting potent anti-inflammatory and anti-fibrotic action. Additionally, significant improvements in NFS and FIB-4 scores in group 3 highlight the anti-fibrotic potential of combining UDCA and quercetin with standard treatment. Conclusions. The addition of UDCA and quercetin to standard treatment for patients with NAFLD and AF significantly improves liver function, lipid metabolism, and reduces systemic inflammation and fibrosis, compared to standard treatment alone. These findings suggest a synergistic effect of UDCA and quercetin, offering a promising therapeutic strategy for managing the complex interplay between NAFLD and AF.
неалкогольна жирова хвороба печінки; фібриляція передсердь; урсодезоксихолева кислота; кверцетин; функція печінки; системне запалення; фіброз
non-alcoholic fatty liver disease; atrial fibrillation; ursodeoxycholic acid; quercetin; liver function; systemic inflammation; fibrosis
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Le MH, Yeo YH, Li X, et al. 2019 Global NAFLD Prevalence: A Systematic Review and Meta-analysis. Clinical Gastroenterology and Hepatology. 2022 Dec;20(12):2809-2817.e28. doi: 10.1016/j.cgh.2021.12.002.
- Riazi K, Azhari H, Charette JH, et al. The prevalence and incidence of NAFLD worldwide: a systematic review and meta-analysis. Lancet Gastroenterol Hepatol. 2022 Sep;7(9):851-61. doi: 10.1016/S2468-1253(22)00165-0.
- Heijman J, Linz D, Schotten U. Dynamics of Atrial Fibrillation Mechanisms and Comorbidities. Annu Rev Physiol. 2021 Feb 10;83(1):83-106. doi: 10.1146/annurev-physiol-031720-085307.
- Kornej J, Börschel CS, Benjamin EJ, Schnabel RB. Epidemiology of Atrial Fibrillation in the 21st Century. Circ Res. 2020 Jun 19;127(1):4-20. doi: 10.1161/CIRCRESAHA.120.316340.
- Mantovani A, Dalbeni A. Treatments for NAFLD: State of Art. Int J Mol Sci. 2021 Feb 26;22(5):2350. doi: 10.3390/ijms22052350.
- Stan SI, Biciușcă V, Clenciu D, Mitrea A, Boldeanu MV, et al. The therapeutic mechanisms and beneficial effects of ursodeoxycholic acid in the treatment of nonalcoholic fatty liver disease: a systematic review. Med Pharm Rep. 2023 Oct 4;97(1):12-25. doi: 10.15386/mpr-2629.
- Azeem M, Hanif M, Mahmood K, Ameer N, Chughtai FRS, Abid U. An insight into anticancer, antioxidant, antimicrobial, antidiabetic and anti-inflammatory effects of quercetin: a review. Polymer Bulletin. 2023 Jan 30;80(1):241-62. doi: 10.1007/s00289-022-04091-8.
- EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol. 2016 Jun;64(6):1388-402. doi: 10.1016/j.jhep.2015.11.004.
- Hindricks G, Potpara T, Dagres N, Arbelo E, Bax JJ, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2021 Feb 1;42(5):373-498. doi: 10.1093/eurheartj/ehaa612.
- Sterling RK, Lissen E, Clumeck N, et al. Development of a simple noninvasive index to predict significant fibrosis in patients with HIV/HCV coinfection. Hepatology. 2006 Jun;43(6):1317-25. doi: 10.1002/HEP.21178.
- Angulo P, Hui JM, Marchesini G, et al. The NAFLD fibrosis score: a noninvasive system that identifies liver fibrosis in patients with NAFLD. Hepatology. 2007 Apr;45(4):846-54. doi: 10.1002/HEP.21496.
- Raunsai MM, Elfahmi E, Chahyadi A, Suhandono S, Kristianti T, Al Muqarrabun LMR. Ursodeoxycholic acid: a systematic review on the chemical and biochemical properties, biosynthesis, sources and pharmacological activities. Current Research in Biosciences and Biotechnology. 2021 Aug 31;3(1):178-85. doi: 10.5614/crbb.2021.3.1/UJZVBNA0.
- Cao P, Wang Y, Zhang C, Sullivan MA, et al. Quercetin ameliorates nonalcoholic fatty liver disease (NAFLD) via the promotion of AMPK-mediated hepatic mitophagy. J Nutr Biochem. 2023 Oct;120:109414. doi: 10.1016/j.jnutbio.2023.109414.
- Wu P, Zhao J, Guo Y, Yu Y, Wu X, Xiao H. Ursodeoxycholic acid alleviates nonalcoholic fatty liver disease by inhibiting apoptosis and improving autophagy via activating AMPK. Biochem Biophys Res Commun. 2020 Aug;529(3):834-8. doi: 10.1016/j.bbrc.2020.05.128.
- Li Y, Li T, Zhou Z, Xiao Y. Emerging roles of Galectin-3 in diabetes and diabetes complications: A snapshot. Rev Endocr Metab Disord. 2022;23(3):569-77. doi: 10.1007/s11154-021-09704-7.
- Xu WD, Huang Q, Huang AF. Emerging role of galectin family in inflammatory autoimmune diseases. Autoimmun Rev. 2021;20(7):102847. doi: 10.1016/j.autrev.2021.102847.
- Kadler KE, Hill A, Canty-Laird EG. Collagen fibrillogenesis: fibronectin, integrins, and minor collagens as organizers and nucleators. Curr Opin Cell Biol. 2008 Oct 1;20(5):495-501. doi: 10.1016/J.CEB.2008.06.008.
- Atalar MN, Abuşoğlu S, Ünlü A, Tok O, İpekçi SH, et al. Assessment of serum galectin-3, methylated arginine and Hs-CRP levels in type 2 diabetes and prediabetes. Life Sci. 2019 Aug 15;231:116577. doi: 10.1016/J.LFS.2019.116577.
- Homsak E, Gruson D. Soluble ST2: A complex and diverse role in several diseases. Clin Chim Acta. 2020 Aug 1;507:75-87. doi: 10.1016/J.CCA.2020.04.011.
- Castiglione V, Chiriaco’ M, Aimo A, et al. Prognostic value of sST2 in heart failure patients with diabetes. Eur Heart J. 2021 Oct 12;42 (Suppl. 1). Available from: https://academic.oup.com/eurheartj/article/42/Supplement_1/ehab724.0869/6394967.
- Zhang T, Xu C, Zhao R, Cao Z. Diagnostic Value of sST2 in Cardiovascular Diseases: A Systematic Review and Meta-Analy–sis. Front Cardiovasc Med. 2021 Jul 23;8:697837. doi: 10.3389/fcvm.2021.697837.
- Mantovani A. Nonalcoholic Fatty Liver Disease (NAFLD) and Risk of Cardiac Arrhythmias: A New Aspect of the Liver-heart Axis. J Clin Transl Hepatol. 2017 Jun 6;5(2):134. doi: 10.14218/JCTH.2017.00005.
- Ismaiel A, Dumitraşcu DL. Cardiovascular Risk in Fatty Li–ver Disease: The Liver-Heart Axis — Literature Review. Front Med (Lausanne). 2019 Sep 13;6:202. doi: 10.3389/fmed.2019.00202.