Журнал "Гастроэнтерология" Том 58, №2, 2024
Вернуться к номеру
Вплив віку, індексу маси тіла та статі на сонографічні показники печінки у пацієнтів з метаболічно асоційованою стеатотичною хворобою печінки
Авторы: Ягмур В.Б., Демешкіна Л.В., Меланіч С.Л., Кислова Р.М.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
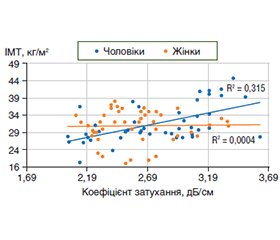
Актуальність. Захворюваність на метаболічно асоційовану стеатотичну хворобу печінки (МАСХП) зростає поряд із зростанням поширеності ожиріння. Між двома патологіями існують тісні взаємозв’язки, що обумовлені функціонуванням жирової тканини як ендокринного органа зі складним впливом на різні метаболічні процеси. Відомо, що жінки в пременопаузі менш схильні до жирової дистрофії печінки, ніж чоловіки. Метою дослідження було вивчити вплив статі, індексу маси тіла (ІМТ) та віку на сонографічні показники та ступінь стеатозу печінки у хворих на метаболічно асоційовану стеатотичну хворобу печінки. Матеріали та методи. У дослідження було включено 92 пацієнти з МАСХП — 48 жінок та 44 чоловіки. Критеріями включення була метаболічно асоційована жирова хвороба печінки, критеріями виключення — будь-які неметаболічні фактори хронічного дифузного захворювання печінки. Пацієнти були розподілені на групи за статтю та віком. У жінок розподілення за віком відбувалось згідно з наявність та відсутністю менопаузи, чоловіки були розподілені на групи до та після 45 років — умовний вік початку згасання гонадотропної функції. Аналіз структурних змін печінки, а саме оцінка розмірів, контурів, структури та ехогенності та візуалізація судин у В-режимі проводилась за допомогою ультразвукового дослідження на апараті Toshiba Xario 660 (Japan). Оцінка ступеня стеатозу — за контрольованим параметром ультразвукового затухання (КЗ). Результати. У чоловіків розміри правої, лівої та хвостатої долі печінки були вірогідно більшими (р < 0,05), ніж у жінок, що обумовлено більшою масою чоловіків за відсутності різниці між показниками ІМТ. За різним ступенем стеатозу вірогідної різниці між чоловіками та жінками не спостерігалось (р > 0,05). Був виявлений позитивний кореляційний зв’язок середньої сили (r = 0,63) між ІМТ та КЗ у чоловіків, у жінок зв’язок між цими показниками був відсутній. Утім, при аналізі кореляцій у жінок різного віку, розподілених згідно з наявністю менопаузи, виявлялось, що до менопаузи залежності показників стеатозу від ІМТ не було, тоді як з настанням менопаузи коефіцієнт кореляції між цими показниками вже становив 0,39 (р < 0,02). Висновки. Вірогідної різниці між частотою різних ступенів стеатозу при МАСХП за показниками КЗ у чоловіків та жінок не було. Існувала залежність вираженості стеатозу печінки від ІМТ у чоловіків, залежність стеатозу від ІМТ у жінок проявлялась лише з віком, починаючи із періоду менопаузи, що дозволяє припускати захисну роль жіночих статевих гормонів.
Background. The incidence of metabolic dysfunction-associated steatotic liver disease (MASLD) is increasing along with the increasing prevalence of obesity. There are close relationships between these two pathologies due to the functioning of adipose tissue as an endocrine organ with a complex influence on various metabolic processes. It is known that premenopausal women are less prone to fatty liver disease than men. The aim was to study the influence of gender, body mass index (BMI) and age on sonographic indicators and the degree of liver steatosis in patients with metabolic dysfunction-associated steatotic liver disease. Materials and methods. Ninety-two patients with MASLD were included in the study, 48 women and 44 men. Inclusion criterion was metabolic dysfunction-associated steatotic liver disease, exclusion criteria were any non-metabolic factors of chronic diffuse liver disease. Patients were divided into groups by gender and age. Women were divided by age according to the presence and absence of menopause, men were divided into groups below and above 45 years — the conventional age of the beginning of the decline in gonadotropic function. The analysis of structural changes of the liver, namely the assessment of the size, contours, structure, echogenicity, and visualization of blood vessels in the B-mode was carried out with the help of ultrasound examination on Toshiba Xario 660 (Japan). The degree of steatosis was assessed by the controlled attenuation parameter. Results. In men, the right, left and caudate liver lobes were significantly larger (p < 0.05) than in women, which is due to the higher weight of men in the absence of a difference in the BMI. There was no significant difference between men and women in degree of steatosis (p > 0.05). A moderate positive correlation (r = 0.63) was found between BMI and the controlled attenuation parameter; in women, there was no connection between these indicators. Analysis of correlations in women of different ages, divided by the presence of menopause, found that before menopause, there was no dependence of steatosis indicators on BMI, while with the onset of menopause, the coefficient of correlation between these indicators was 0.39 (р < 0.02). Conclusions. No significant difference was found between the frequency of various degrees of steatosis in MASLD according to the controlled attenuation parameter in men and women. There was a dependence of the severity of liver steatosis on the BMI in men, the dependence of steatosis on the body mass index in women was manifested starting from the menopause period, which suggests the protective role of female sex hormones.
метаболічно асоційована стеатотична хвороба печінки; стать; індекс маси тіла; вік; ступінь стеатозу; коефіцієнт ультразвукового затухання
metabolic dysfunction-associated steatotic liver disease; gender; body mass index; age; steatosis degree; controlled attenuation parameter
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Maurice J., Manousou P. Non-alcoholic fatty liver disease. Clin Med (Lond). 2018;18(3):245-250. doi: 10.7861/clinmedicine.18-3-245. PMID: 29858436; PMCID: PMC6334080.
- Younossi Z.M., Golabi P., Paik J.M., Henry A., Van Dongen C., Henry L. The global epidemiology of nonalcoholic fatty li–ver disease (NAFLD) and nonalcoholic steatohepatitis (NASH): a systematic review. Hepatology. 2023;77(4):1335-1347. doi: 10.1097/HEP.0000000000000004. PMID: 36626630; PMCID: PMC10026948.
- Rohm T.V., Meier D.T., Olefsky J.M., Donath M.Y. Inflammation in obesity, diabetes, and related disorders. Immunity. 2022, Jan 11;55(1):31-55. doi: 10.1016/j.immuni.2021.12.013. PMID: 35021057; PMCID: PMC8773457.
- Wong R.J., Aguilar M., Cheung R., et al. Nonalcoholic steatohepatitis is the second leading etiology of liver disease among adults awaiting liver transplantation in the United States. Gastroentero–logy. 2015;148:547-55. doi: 10.1053/j.gastro.2014.11.039. PMID: 25461851.
- Pais R., Barritt A.S. 4th, Calmus Y. et al. NAFLD and liver transplantation: Current burden and expected challenges. J. Hepatol. 2016;65(6):1245-1257. doi: 10.1016/j.jhep.2016.07.033. PMID: 27486010; PMCID: PMC5326676.
- Stojsavljević S., Gomerčić Palčić M., Virović Jukić L, Smirčić Duvnjak L., Duvnjak M. Adipokines and proinflammatory cytokines, the key mediators in the pathogenesis of nonalcoholic fatty liver disease. World J. Gastroenterol. 2014;20(48):18070-91. doi: 10.3748/wjg.v20.i48.18070. PMID: 25561778; PMCID: PMC4277948.
- Ramai D., Facciorusso A., Vigandt E., et al. Progressive Liver Fibrosis in Non-Alcoholic Fatty Liver Disease. Cells. 2021;10(12):3401. doi: 10.3390/cells10123401. PMID: 34943908; PMCID: PMC8699709.
- Ahadi M., Molooghi K., Masoudifar N., Namdar A.B., Vossoughinia H., Farzanehfar M. A review of non-alcoholic fatty liver di–sease in non-obese and lean individuals. J. Gastroenterol., Hepatol. 2021;36(6):1497-1507. doi: 10.1111/jgh.15353. PMID: 33217052.
- Zohara Z., Adelekun A., Seffah K.D., et al. The Prospect of Non-Alcoholic Fatty Liver Disease in Adult Patients with Metabolic Syndrome: A Systematic Review. Cureus. 2023;15(7):e41959. doi: 10.7759/cureus.41959. PMID: 37588314; PMCID: PMC10427027.
- Kastberg S.E., Lund H.S., De Lucia-Rolfe E., et al. Hepatic steatosis is associated with anthropometry, cardio-metabolic disease risk, sex, age and urbanisation, but not with ethnicity in adult Kenyans. Trop. Med. Int. Health. 2022;27(1):49-57. doi: 10.1111/tmi.13696. PMID: 34704339.
- Lonardo A., Nascimbeni F., Ballestri S., et al. Sex Differences in Nonalcoholic Fatty Liver Disease: State of the Art and Identification of Research Gaps. Hepatology. 2019;70(4):1457-1469. doi: 10.1002/hep.30626. PMID: 30924946; PMCID: PMC6766425.
- Sayaf K., Gabbia D., Russo F.P., De Martin S. The Role of Sex in Acute and Chronic Liver Damage. Int. J. Mol. Sci. 2022;23(18):10654. doi: 10.3390/ijms231810654. PMID: 36142565; PMCID: PMC9505609.
- Shen M., Shi H. Sex Hormones and Their Receptors Regulate Liver Energy Homeostasis. Int J Endocrinol. 2015;2015:294278. doi: 10.1155/2015/294278. PMID: 26491440; PMCID: PMC4600502.
- Martelli M., Zingaretti L., Salvio G., Bracci M., Santarelli L. Influence of Work on Andropause and Menopause: A Systematic Review. Int. J. Environ. Res. Public Health. 2021;18(19):10074. doi: 10.3390/ijerph181910074. PMID: 34639376; PMCID: PMC8508409.
- Bryzgalova G., Gao H., Ahren B., et al. Evidence that oestrogen receptor-alpha plays an important role in the regulation of glucose homeostasis in mice: insulin sensitivity in the liver. Diabetologia. 2006;49(3):588-97. doi: 10.1007/s00125-005-0105-3. PMID: 16463047.
- Mohamad N.V., Wong S.K., Wan Hasan W.N., et al. The relationship between circulating testosterone and inflammatory cytokines in men. Aging Male. 2019;22(2):129-140. doi: 10.1080/13685538.2018.1482487. PMID: 29925283.
- Navarro G., Allard C., Xu W., Mauvais-Jarvis F. The role of androgens in metabolism, obesity, and diabetes in males and females. Obesity (Silver Spring). 2015;4:713-9. doi: 10.1002/oby.21033. Epub 2015 Mar 6. PMID: 25755205; PMCID: PMC4380643.
- D’Abbondanza M., Ministrini S., Pucci G., et al. Very Low-Carbohydrate Ketogenic Diet for the Treatment of Severe Obesity and Associated Non-Alcoholic Fatty Liver Disease: The Role of Sex Differences. Nutrients. 2020;12(9):2748. doi: 10.3390/nu12092748. PMID: 32916989; PMCID: PMC7551320.
- Pafili K., Paschou S.A., Armeni E., Polyzos S.A., Goulis D.G., Lambrinoudaki I. Non-alcoholic fatty liver disease through the female lifespan: the role of sex hormones. J Endocrinol Invest. 2022;45(9):1609-1623. doi: 10.1007/s40618-022-01766-x. PMID: 35303270.
- DiStefano J.K. NAFLD and NASH in Postmenopausal Women: Implications for Diagnosis and Treatment. Endocrinology. 2020;161(10):bqaa134. doi: 10.1210/endocr/bqaa134. PMID: 32776116; PMCID: PMC7473510.
- van den Beld A.W., Kaufman J.M., Zillikens M.C., Lamberts S.W.J., Egan J.M., van der Lely A.J. The physiology of endocrine systems with ageing. Lancet Diabetes Endocrinol. 2018;6(8):647-658. doi: 10.1016/S2213-8587(18)30026-3. PMID: 30017799; PMCID: PMC6089223.
- Nieschlag E. Late-onset hypogonadism: a concept comes of age. Andrology. 2020;8(6):1506-1511. doi: 10.1111/andr.12719. PMID: 31639279.
- The method of diagnosing liver steatosis in patients with non-alcoholic fatty liver disease: pat. 136479 Ukraine: IPC А61В 8/00 А61В 8/72. No. u2019 00968; statement 30.01.2019; published 27.08.2019, Bul. 16. 3 p. [in Ukrainian].
- Sasso M., Beaugrand M., de Ledinghen V., et al. Controlled attenuation parameter (CAP): a novel VCTE™ guided ultrasonic attenuation measurement for the evaluation of hepatic steatosis: preliminary study and validation in a cohort of patients with chronic liver disease from various causes. Ultrasound Med Biol. 2010;36(11):1825-35. doi: 10.1016/j.ultrasmedbio.2010.07.005. PMID: 20870345.
- Hong T., Chen Y., Li X., Lu Y. The Role and Mechanism of Oxidative Stress and Nuclear Receptors in the Development of NAFLD. Oxidative medicine and cellular longevity. 2021;2021:6889533.
- Nishihawa H., Ki Kim S., Asai A. Body Composition in Chronic Liver Disease Int J. Mol Sci. 2024 Jan 12;25(2):964. doi: 10.3390/ijms25020964.
- Benavides-Aguilar J.A., Torres-Copado A., Isidoro Sanchez J., et al. The Regulatory Role of MicroRNAs in Obesity and Obesity-Derived Ailments Genes (Basel). 2023 Nov 13;14(11):2070. doi: 10.3390/genes14112070.
- Bell M.D., Long Th., Roden A.C., et al. Updating Normal Organ Weights Using a Large Current Sample Database. Arch. Pathol. Lab. Med. 2022 Dec 1;146(12):1486-1495. doi: 10.5858/arpa.2021-0287-OA.
- Ramirez-Velez R., Garcia-Hermoso A., Correa-Rodriguez M., Izquierdo M. Defining values for controlled attenuation parameter and liver stiffness in youth without liver disease. Pediatr. Res. 2022 Mar;91(4):912-920. doi: 10.1038/s41390-021-01441-6.
- Broering D., Shawkat M., Albenmousa A., et al. Validating controlled attenuation parameter in the assessment of hepatic steatosis in living liver donors. PLoS One. 2021 May;16(5):e0251487. doi: 10.1371/journal.pone.0251487. eCollection 2021.
- Petroff D., Blank V., Newsome Ph.N., et al. Assessment of hepatic steatosis by controlled attenuation parameter using the M and XL probes: an individual patient data meta-analysis. Meta-Analy–sis Lancet. Gastroenterol., Hepatol. 2021 Mar;6(3):185-198 doi: 10.1016/S2468-1253(20)30357-5].
- Piccini R., Rodrigues S.G., Montani M., et al. Controlled attenuation parameter reflects steatosis in compensated advanced chronic liver disease. Liver. Int. 2020 May;40(5):1151-1158. doi: 10.1111/liv.14325.
- Mjelle A.B., Mulabecirovic A., Olafsdottir E.J., Gilja O.H., Havre R.F., Vesterhus M. Controlled Attenuation Parameter in Healthy Individuals Aged 8-70 Years. Ultrasound Int. Open. 2021 Apr;7(1):E6-E13. doi: 10.1055/a-1461-4714.
- Somda S., Lebrun A., Tranchart H., et al. Adaptation of controlled attenuation parameter (CAP) measurement depth in morbidly obese patients addressed for bariatric surgery. PLoS One. 2019;24;14(5):e0217093. doi: 10.1371/journal.pone.0217093.
- Sorrentino D., Zhou S.L., Kokkotou E., Berk P.D. Sex Differences in Hepatic Fatty Acid Uptake Reflect a Greater Affinity of the Transport System in Females. Am. J. Physiol. 1992;263:G380-G385.
- Ståhlberg N., Rico-Bautista E., Fisher R.M., et al. Female-Predominant Expression of Fatty Acid Translocase/CD36 in Rat and Human Liver. Endocrinology. 2004;145:1972-1979.
- Trapani L., Segatto M., Pallottini V. Regulation and Dere–gulation of Cholesterol Homeostasis: The Liver as a Metabolic “Power Station”. World J. Hepatol. 2012;4:184-190.