Журнал "Гастроэнтерология" Том 58, №2, 2024
Вернуться к номеру
Можливість застосування пробіотичних засобів на основі бактерій роду Bacillus у хворих на постінфекційний синдром подразненої товстої кишки після перенесеної коронавірусної інфекції
Авторы: Господарський І.Я., Грищук Л.А., Бойко Т.В.
Тернопільський національний медичний університет імені І.Я. Горбачевського, м. Тернопіль, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
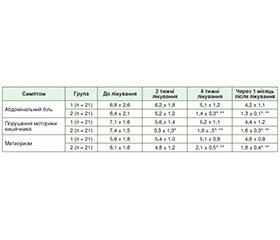
Актуальність. В Україні однією з найбільш стрімко наростаючих проблем сімейної медицини і гастроентерології стає синдром подразненого кишечника (СПК). Цьому особливо посприяла пандемія COVID-19. Мета: оптимізація лікування хворих на постінфекційний синдром подразненого кишечника після перенесеної інфекції COVID-19 з використанням у комплексному лікуванні пробіотичного засобу на основі бактерій роду Bacillus. Матеріали та методи. Проведено просте рандомізоване клінічне дослідження з вивчення ефективності й безпеки застосування пробіотичного засобу на основі 5 видів бактерій роду Bacillus у хворих на постінфекційний постковідний СПК. Усього обстежено 42 пацієнти (26 жінок, 16 чоловіків) віком від 26 до 48 років (середній вік становив 32 ± 11 років). Діагноз постінфекційного СПК встановлювали відповідно до Римських критеріїв ІV. Тяжкість перебігу оцінювали за шкалою тяжкості симптомів СПК (Irritable Bowel Syndrome — Symptom Severity Scale, IBS-SSS). Усім хворим виконувалося комплексне лабораторне й інструментальне обстеження, що включало загальноклінічне й біохімічне дослідження крові (печінкові проби, серологічне дослідження на наявність збудників кишкових інфекцій), дослідження калу на кальпротектин, яйця глистів і паразитів, ультрасонографію органів черевної порожнини). Результати. У динаміці спостереження відзначали певне зниження вираженості клінічної симптоматики в обох групах. Але при цьому через 2 тижні лікування була виявлена тенденція до швидшого зменшення вираженості таких симптомів, як абдомінальний біль, порушення моторики кишечника, метеоризм, у тих пацієнтів, які отримували пробіотик, хоча ця тенденція була вірогідною тільки щодо метеоризму (р < 0,05), але не щодо болю в животі й кишкової моторики (р > 0,05). Через 4 тижні лікування виявлено вірогідно кращі показники щодо вираженості всіх досліджуваних симптомів у групі пацієнтів, які отримували пробіотик (р < 0,05). Ця різниця зберігалася навіть через 1 місяць після завершення лікування. Характерно, що вже протягом перших двох тижнів спостереження в пацієнтів другої групи суттєво зменшилася кількість днів на тиждень, протягом яких хворі мали потребу в прийомі спазмолітиків і/або регуляторів кишкової моторики (3,1 ± 0,4 проти 6,7 ± 0,9 у групі порівняння, р < 0,05). Ще більш вираженою була ця різниця через 4 тижні лікування. Украй важливим є те, що в пацієнтів, які отримували пробіотик, практично не було потреби в прийомі засобів симптоматичної терапії для усунення проявів абдомінального болю і порушень кишкової моторики. Указані зміни і тенденції збереглися і через 1 місяць після завершення курсу лікування. Висновки. Застосування пробіотичного засобу на основі бактерій роду Bacillus продемонструвало позитивні результати при лікуванні хворих на СПК після перенесеної інфекції COVID-19. Його використання сприяло вірогідно швидшому зникненню таких симптомів постінфекційного СПК, як абдомінальний біль, метеоризм, і нормалізувало моторику кишечника (р < 0,05 порівняно з контрольною групою), а також різко зменшувало потребу в застосуванні засобів симптоматичної терапії (р < 0,05).
Background. In Ukraine, one of the most rapidly growing problems of family medicine and gastroenterology is irritable bowel syndrome (IBS). The coronavirus disease 2019 (COVID-19) pandemic and the beginning of a large-scale military invasion of Ukraine contributed to this. Aim: to optimize the treatment of patients with post-infectious irritable bowel syndrome after COVID-19 infection with the use of Bacillus probiotics in the comprehensive treatment. Materials and methods. A simple randomized clinical trial was conducted to study the effectiveness and safety of а 5-strain Bacillus probiotic in patients with post-COVID IBS. A total of 42 patients (26 women and 16 men) aged 26 to 48 years (average of (32 ± 11) years) were examined. The diagnosis of post-infectious IBS was established according to the Rome IV criteria. The severity was assessed using the IBS Symptom Severity Scale. All patients underwent a comprehensive laboratory and instrumental examination, which included general clinical and biochemical blood tests (liver tests, serological tests for infectious markers), stool tests for calprotectin, worm eggs, parasites, and abdominal ultrasonography. Results. In the dynamics of observation, a certain decrease was noted in the severity of clinical symptoms in both groups. But at the same time, after 2 weeks of treatment, there was a tendency to a faster decrease in the severity of symptoms such as abdominal pain, intestinal motility disorders, and flatulence in patients who received the probiotic, although this trend was significant only for flatulence (p < 0.05), but not for abdominal pain and intestinal motility (p > 0.05). After 4 weeks of treatment, significantly better indicators regarding the severity of all studied symptoms were found in the group of patients receiving the probiotic (p < 0.05). This difference persisted even 1 month after the end of treatment. Characteristically, during the first two weeks of observation, the number of days per week during which patients did not need to take antispasmodics and/or regulators of intestinal motility significantly decreased in the second group (3.1 ± 0.4 vs 6.7 ± 0.9 in the comparison group, p < 0.05). This difference was even more pronounced after 4 weeks of treatment. It is extremely important that the patients who received the probiotic practically did not need to take symptomatic therapy to eliminate the manifestations of abdominal pain and intestinal motility disorders. The indicated changes and trends persisted one month after the end of treatment. Conclusions. The use of Bacillus probiotic has shown positive results in the treatment of patients with IBS after COVID-19 infection. Its administration contributed to a significantly faster disappearance of the symptoms of post-infectious IBS, such as abdominal pain, flatulence, normalized intestinal motility (p < 0.05 compared to the control group), and also dramatically reduced the need for symptomatic therapy (p < 0.05).
синдром подразненого кишечника; постінфекційний синдром подразненого кишечника; COVID-19; пробіотики; Bacillus
irritable bowel syndrome; post-infectious irritable bowel syndrome; COVID-19; probiotics; Bacillus
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Sperber AD, Bangdiwala SI, Drossman DA, et al. Worldwide prevalence and burden of functional gastrointestinal disorders, results of Rome Foundation Global Study. Gastroenterology. 2021;160:99-114. doi: 10.1053/j.gastro.2020.04.014.
- Gwee KA, Ghoshal UC, Chen M. Irritable bowel syndrome in Asia: pathogenesis, natural history, epidemiology, and management. J Gastroenterol Hepatol. 2018;33:99-110. doi: 10.1111/jgh.13987.
- Barbara G, Feinle-Bisset C, Ghoshal UC, et al. The intestinal microenvironment and functional gastrointestinal disorders. Gastroenterology. 2016;150:1305-1318. doi: 10.1053/j.gastro.2016.02.028.
- Ghoshal UC. Marshall and Warren Lecture 2019: a paradigm shift in pathophysiological basis of irritable bowel syndrome and its implication on treatment. J Gastroenterol Hepatol. 2020;35:712-721. doi: 10.1111/jgh.15032.
- Rusu F, Mocanu L, Dumitraşcu DL. Phenotypic features of patients with post-infectious irritable bowel syndrome. Med Pharm Rep. 2019;92(3):239-245. doi: 10.15386/mpr-1317.
- Sinagra E, Pompei G, Tomasello G, Cappello F. Inflammation in irritable bowel syndrome: Myth or new treatment target? World J Gastroenterol. 2016;22(7):2242-55. doi: 10.3748/wjg.v22.i7.2242.
- Drossman DA, Hasler WL. Rome IV-functional GI disorders: disorders of gut-brain interaction. Gastroenterology. 2016;150:1257-1261. doi: 10.1053/j.gastro.2016.03.035.
- Barbara G, Grover M, Bercik P, et al. Rome Foundation Wor–king Team report on post-infection irritable bowel syndrome. Gastroenterology. 2019;156:46-58. doi: 10.1053/j.gastro.2018.07.011.
- Savarino E, Zingone F, Barberio B, Marasco G, et al. Functional bowel disorders with diarrhoea: Clinical guidelines of the United European Gastroenterology and European Society for Neurogastroenterology and Motility. United European Gastroenterol J. 2022;10(6):556-584. doi: 10.1002/ueg2.12259.
- Klem F, Wadhwa A, Prokop LJ, et al. Prevalence, risk factors, and outcomes of irritable bowel syndrome after infectious enteritis: a systematic review and meta-analysis. Gastroenterology. 2017;152:1042-1054. doi: 10.1053/j.gastro.2016.12.039.
- Ghoshal UC, Rahman MM. Post-infection irritable bowel syndrome in the tropical and subtropical regions: Vibrio cholerae is a new cause of this well-known condition. Indian J Gastroenterol. 2019;38:87-94. doi: 10.1007/s12664-019-00959-2.
- Lupu VV, Ghiciuc CM, Stefanescu G, Mihai CM. Emerging role of the gut microbiome in post-infectious irritable bowel syndrome: A literature review. World J Gastroenterol. 2023;29(21):3241-3256. doi: 10.3748/wjg.v29.i21.3241.
- Andrejczyn M, Wasyliewa N, Gospodarski I. Some aspects of epidemiology of HCV infections in Ukraine. Przegla̧d epidemiologiczny. 2005;59(2):499-501. PMID: 16190559.
- Schmulson M, Ghoshal UC, Barbara G. Managing the inevitable surge of post-COVID-19 functional gastrointestinal disorders. Am J Gastroenterol. 2021;116:4-7. doi: 10.14309/ajg.0000000000001062.
- Scialo F, Daniele A, Amato F. ACE2 The Major Cell Entry Receptor for SARS-CoV-2. Lung. 2020;198(6):867-877. doi: 10.1007/s00408-020-00408-4.
- Chan WW, Grover M. The COVID-19 Pandemic and Post-Infection Irritable Bowel Syndrome What Lies Ahead for Gastroentero–logists. Clinical Gastroenterology and Hepatology. 2022;20(10):2195-2197. doi: 10.1016/j.cgh.2022.05.044.
- Keystone EC, Shirinsky VS, Simon LS, et al. Efficacy and safety of CH-1504, a metabolically stable antifolate, in patients with active rheumatoid arthritis: Results of a phase II multicenter randomized study. J Rheumatol. 2021;38(9):1875-83. doi: 10.3899/jrheum.101038.
- Kumar A, Arora A, Sharma P, et al. Gastrointestinal and hepatic manifestations of corona virus disease-19 and their relationship to severe clinical course: a systematic review and meta-analysis. Indian J Gastroenterol. 2020;39:268-284. doi: 10.1007/s12664-020-01058-3.
- Ghoshal UC, Ghoshal U, Mathur A, et al. The spectrum of gastrointestinal symptoms in patients with coronavirus disease-19: predictors, relationship with disease severity, and outcome. Clin Transl Gastroenterol. 2020;11:e00259. doi: 10.14309/ctg.0000000000000259.
- Wong MC, Huang J, Lai C, Ng R, Chan FK, Chan PK. Detection of SARS-CoV-2 RNA in fecal specimens of patients with confirmed COVID-19: a meta-analysis. J Infect. 2020;81:e31-e38. doi: 10.1016/j.jinf.2020.06.012.
- Fukudo S, Okumura T, Inamori M. Evidence-based clinical practice guidelines for irritable bowel syndrome 2020. J Gastroenterol. 2021;56(3):193-217. doi: 10.1007/s00535-020-01746-z.
- Napolitano M, Fasulo E, Ungaro F, Massimino L, Sinagra E, Danese S, Mandarino FV. Gut Dysbiosis in Irritable Bowel Syndrome: A Narrative Review on Correlation with Disease Subtypes and Novel Therapeutic Implications. Microorganisms. 2023;11(10):2369. doi: 10.3390/microorganisms11102369.
- Huang KY, Wang FY, Lv M, Ma XX, Tang XD, Lv L. Irritable bowel syndrome: Epidemiology, overlap disorders, pathophysiology and treatment. World J Gastroenterol. 2023 Jul 14;29(26):4120-4135. doi: 10.3748/wjg.v29.i26.4120.
- Shin A, Kashyap PC. Multi-omics for biomarker approa–ches in the diagnostic evaluation and management of abdominal pain and irritable bowel syndrome: what lies ahead. Gut Microbes. 2023;15(1):2195792. doi: 10.1080/19490976.2023.2195792.
- Effenberger M, Grabherr F, Mayr L, et al. Faecal calprotectin indicates intestinal inflammation in COVID-19. Gut. 2020;69:1543-1544. doi: 10.1136/gutjnl-2020-321388.
- Reza-Zaldívar EE, Hernández-Sapiéns MA, Minjarez B, et al. Infection mechanism of SARS-COV-2 and its implication on the nervous system. Front Immunol. 2021;11:621735. doi: 10.3389/fimmu.2020.621735.1522e5bc505c4017a8639701d8463bc8.
- Ha S, Jin B, Clemmensen B, et al. Serotonin is eleva–ted in COVID-19-associated diarrhoea. Gut. 2021;70:2015-2017. doi: 10.1136/gutjnl-2020-323542.
- Harris LA. Rifaximin for irritable bowel syndrome (IBS) in Gulf War veterans: losing the battle but winning the war? Dig Dis Sci. 2019;64:609-610. doi: 10.1007/s10620-019-05505-w.
- Tuteja AK, Talley NJ, Stoddard GJ, Verne GN. Double-blind placebo-controlled study of rifaximin and lactulose hydrogen breath test in Gulf War veterans with irritable bowel syndrome. Dig Dis Sci. 2019;64:838-845. doi: 10.1007/s10620-018-5344-5.
- Dunlop SP, Jenkins D, Neal KR, et al. Randomized, double-blind, placebo-controlled trial of prednisolone in post-infectious irritable bowel syndrome. Aliment Pharmacol Ther. 2003;18:77-84. doi: 10.1046/j.1365-2036.2003.01640.x.
- Yeoh YK, Zuo T, Lui GC, et al. Gut microbiota composition reflects disease severity and dysfunctional immune responses in patients with COVID-19. Gut. 2021;70:698-706. doi: 10.1136/gutjnl-2020-323020.
- Zuo T, Zhang F, Lui GC, et al. Alterations in gut microbiota of patients with COVID-19 during time of hospitalization. Gastroenterology. 2020;159:944-955. doi: 10.1053/j.gastro.2020.05.048.
- Benjak Horvat I, Gobin I, Kresović A, Hauser G. How can probiotic improve irritable bowel syndrome symptoms? World J Gastrointest Surg. 2021;13(9):923-940. doi: 10.4240/wjgs.v13.i9.923.
- Сафронова Л.А., Иляш В.М. Биосинтетическая активность бацилл, обусловливающая их пробиотический эффект. Мікробіол. журн. 2017. Т. 79. № 6. С. 120-136. DOI: 10.32471/rheumatology.2707-6970.89.17262.
- Belizário J.E., Faintuch J. Microbiome and Gut Dysbiosis. Exp Suppl. 2018;109:459-476. doi: 10.1007/978-3-319-74932-7_13.
- Chlebicz-Wójcik A, Śliżewska K. Probiotics, Prebiotics, and Synbiotics in the Irritable Bowel Syndrome Treatment: A Review. Biomolecules. 2021;11(8):1154. doi: 10.3390/biom11081154.