Вступ
Гуманітарні кризи, обумовлені збройними конфліктами, постійно зростають і являють собою глобальну проблему для систем охорони здоров’я. Найбільш уразливою групою є діти, які все частіше стають жертвами збройних конфліктів. Повномасштабна вій–на в Україні спричинила тривалу негативну ситуацію, яка сприяє порушенню здоров’я дітей і підлітків. У цих умовах значно збільшується ризик захворюваності на соматичні й психічні хвороби, ускладнюється перебіг хронічних захворювань. Також доведено, що адаптація дитячого організму до різних стресових факторів, які пов’язані з військовим конфліктом, здійснюється через надмірну активізацію нейроендокринної системи і сприяє поширенню ендокринних захворювань [1, 2]. Встановлено, що гострий або хронічний стрес може стати тригером формування автоімунних тиреопатій. Відбувається збільшення частоти новоутворень щитоподібної залози. Реєструють зміни функціонального стану гіпофізарно-тиреоїдної системи з підвищенням рівня тиреоїдних гормонів під час гострого стресу і зменшенням їх продукції в умовах хронічного психічного навантаження.
Згідно з результатами наукових досліджень встановлено, що зі збільшенням віку і стажу ЦД1 відзначається зростання кількості пацієнтів, які мають одне і більше коморбідне автоімунне захворювання, серед яких перше місце посідають автоімунні тиреопатії, насамперед це стосується автоімунного тиреоїдиту (АІТ) [3].
Протягом багатьох років на базі відділення ендокринології ДУ «Інститут охорони здоров’я дітей та підлітків НАМН України» (ДУ «ІОЗДП НАМН») виконувались дослідження, які присвячено вивченню стану тиреоїдної системи в дітей і підлітків із ЦД1. Отримані результати дозволили удосконалити алгоритм діагностики, профілактики й лікування тиреопатій при ЦД1 у дітей і підлітків [4]. Упровадження в клінічну практику зазначеної технології сприяло зменшенню частоти дифузного нетоксичного зоба (ДНЗ) та АІТ серед дітей і підлітків, яких було обстежено протягом 2019–2021 рр., проти показників, визначених на початку 2000-х років.
Однак на сьогодні залишається не визначеним, яким чином змінюється структура тиреопатій у підлітків із ЦД1 в умовах війни в Україні.
Мета дослідження — вивчити стан тиреоїдної системи в підлітків із ЦД1, які знаходяться в несприятливих умовах війни в Україні.
Матеріали та методи
У динаміці спостереження обстежено пацієнтів із ЦД1 9–16 років: 114 — до початку повномасштабної війни в Україні (до 24.02.2022) і 76 пацієнтів — повторно після початку війни в Україні (після 01.10.2022), коли з’явилась можливість провести комплексне обстеження в умовах ендокринологічного відділення ДУ «ІОЗДП НАМН».
Клініко-анамнестичне й лабораторно-інструментальне обстеження хворих проводили відповідно до стандартів медичної допомоги «Цукровий діабет у дітей», затверджених наказом Міністерства охорони здоров’я (МОЗ) України № 413 від 28.02.2023 [5], і протоколу надання медичної допомоги дітям за спеціальністю «дитяча ендокринологія» (наказ МОЗ України № 254 від 27.04.2006 зі змінами, внесеними згідно з наказами МОЗ України № 55 від 03.02.2009 і № 864 від 07.10.2013) [6].
Під час обстеження також визначали концентрації тиреотропного гормону (ТТГ), вільних фракцій тиреоїдних гормонів (fT4 і fT3) методом імуноферментного аналізу на фотометрі Humareader (Німеччина) за допомогою комерційних наборів (набори реагентів фірми «Astra Biotech GmbH», Берлін, Німеччина). Оцінюючи функціональний стан щитоподібної залози (ЩЗ), звертали увагу як на рівень гормонів, так і на величину їх співвідношень [7]. Антитілоутворююча активність оцінювалась за показниками антитіл до тиреопероксидази (АТ ТПО), які визначались імуноферментним методом за допомогою комерційних наборів (набори реагентів фірми «Astra Biotech GmbH», Берлін, Німеччина). Позитивним тест на наявність антитіл вважався при рівні АТ ТПО вище 30 МО/л.
Дослідження проводились відповідно до принципів Гельсінської декларації прав людини, Конвенції Ради Європи про права людини та біомедицину і чинного законодавства України. Протокол дослідження затверджено комісією з медичної етики ДУ «ІОЗДП НАМН». Батьки й пацієнти надали письмову інформовану згоду на участь у дослідженні.
Результати обстеження підлітків об’єднано в електронний банк даних, їх математична обробка була проведена за допомогою пакетів програм SPSS Statistics 17.0, Microsoft Excel 2007. Значущість розходжень відсотків оцінювалася за методом кутового перетворення Фішера (Pϕ). Критичний рівень значущості для перевірки статистичних гіпотез при порівнянні груп прий–мався рівним 0,05.
Результати та обговорення
Обстеження дітей і підлітків із ЦД1 протягом 2019–2021 років дозволило встановити, що частота і характер патології ЩЗ залежали від статі, періоду пубертату, характеру соматостатевого розвитку, віку маніфестації та компенсації діабету. Найчастіше тиреопатії визначали в підлітків з маніфестацією ЦД1 у ранньому пубертаті (80,0 %), у хворих із тривалістю діабету від 5 до 10 років, за умови недостатньої компенсації вуглеводного обміну, серед підлітків з дисгармонійним фізичним розвитком і порушеннями статевого дозрівання [8].
Також було доведено, що наявність тиреопатій з ознаками тиреоїдної недостатності є значущім несприятливим фактором щодо порушень фізичного та статевого розвитку в підлітків із ЦД1 [9].
Саме тому корекція тиреоїдної дисфункції в поєднанні з досягненням оптимального глікемічного контролю на тлі загальностимулюючої терапії є обов’язковою умовою профілактики й лікування патологічного перебігу пубертату у хворих на ЦД1. Відповідно до розробленої технології профілактичні заходи й лікування проводили з урахуванням функціонального стану гіпофізарно-тиреоїдної системи та характеру тиреопатії [10]. У разі еутиреозу або дистиреозу після досягнення оптимального глікемічного конт–ролю призначали препарати калію йодиду (КЙ) у профілактичних або лікувальних вікових дозах. Підліткам з ознаками мінімальної тиреоїдної недостатності (МТН) або субклінічного гіпотиреозу (СГ) лікування починали з монотерапії препаратами КЙ, а в разі її неефективності додавали препарати левотироксину. Для профілактики й лікування тиреопатій пацієнтам із ЦД1 необхідно застосовувати тільки якісні лікарські засоби, до яких відносять Йодомарин® 100/200 і L-Тироксин Берлін-Хемі. Індивідуальне використання Йодомарину® 100/200 забезпечує надходження необхідної вікової фізіологічної кількості йоду до організму у вигляді калію йодиду в точній дозі задля нормального біосинтезу гормонів ЩЗ [11].
Призначення препаратів L-тироксину хворим на ЦД1 показане при прогресуючому збільшенні ТТГ у динаміці, наявності антитиреоїдних автоантитіл і змін морфометричної картини щитоподібної залози; наявності генетичної та автоімунної патології (АІТ, целіакія та інші); порушенні перебігу соматостатевого розвитку; несприятливому прогнозі перебігу ДНЗ у підлітковому віці. Початкова доза левотироксину залежить від функціонального стану ЩЗ і віку пацієнтів [12].
Слід зазначити, що неможливість досягнення нормалізації тиреоїдного статусу може бути обумовлена порушенням умов зберігання пігулок, недотриманням вимог до застосування левотироксину і труднощами щоденного дозування препарату в разі необхідності поділу пігулок на частини. У той же час завдяки технології Snap Tab, яку використовують при виготовленні таблеток L-Тироксину Берлін Хемі, забезпечується стабільна повторюваність дози, а блістер алюміній/алюміній забезпечує захист від сонячного світла, вологи й кисню. Даний препарат не містить лактози, має п’ять дозувань [13]. Усе це сприяє стабільному щоденному дозуванню препарату і досягненню еутиреоїдного стану.
Усі підлітки, які знаходились на обстеженні й лікуванні в ендокринологічному відділенні ДУ «ІОЗДП НАМН» протягом довоєнних років, отримали рекомендації щодо лікування тиреопатій, яке зазвичай продовжували в амбулаторних умовах. Однак після початку повномасштабної війни в Україні 24 лютого 2022 року динамічне спостереження за пацієнтами значно ускладнилося. Дехто з пацієнтів продовжує спілкуватися з ендокринологом в онлайн-режимі й виконувати рекомендації лікаря. Проте значна кількість хворих на ЦД1 припинили проведення рекомендованого лікування тиреопатії і/або не мали змоги контролювати стан тиреоїдної системи.
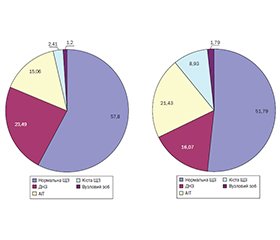
Восени 2022 року була відкрита клініка ДУ «ІОЗДП НАМН» і з’явилась можливість проводити комплексне обстеження й лікування пацієнтів із ЦД1 в умовах ендокринологічного відділення та визначити стан тиреоїдної системи в динаміці спостереження (рис. 1).
Результати обстеження підлітків із ЦД1, які знаходяться в несприятливих умовах війни в Україні, свідчать про зміни в структурі тиреопатій через зменшення частки ДНЗ, збільшення частоти АІТ і виявлення кіст ЩЗ. Слід зазначити, що зменшення частоти ДНЗ відбувалось переважно серед пацієнтів віком 9–13 років, які отримували препарати КЙ із профілактичною та лікувальною метою. Щодо збільшення частоти АІТ, то зазначена тенденція була зареєстрована в усіх вікових групах. Так, у кожного 4-го підлітка 9–13 років і кожного 5-го — 14–18 років було діагностовано АІТ.
Індивідуальний аналіз показників тиреоїдного статусу підлітків із ЦД1 дозволив встановити, що серед хворих, які під час війни продовжували проводити вторинну профілактику і лікування тиреопатій під контролем лікаря тривалий час, зареєстровано зменшення частоти пацієнтів з ознаками гіпотиреозу різного ступеня. Серед них вірогідно збільшилась кількість пацієнтів у стані еутиреозу. За умов припинення лікування зберігалися ознаки тиреоїдної дисфункції та гіпотиреозу.
Після обстеження, за умов виключення АІТ, усім пацієнтам, у яких була досягнута нормалізація показників тиреоїдного профілю, з метою запобігання рецидиву формування тиреоїдної дисфункції було рекомендовано проведення вторинної профілактики Йодомарином® 200 тривалий час. Пацієнти, хворі на ЦД1 з АІТ та ознаками тиреоїдної недостатності, продовжували отримувати препарат L-Тироксин Берлін-Хемі в адекватній дозі.
Висновки
1. Найчастішою коморбідною патологією ЩЗ у дітей і підлітків із ЦД1 є ДНЗ та АІТ.
2. Розроблена у 2007 році технологія профілактики й лікування тиреопатій у пацієнтів із ЦД1 сприяла зменшенню частоти тиреопатій серед підлітків, які були обстежені в довоєнні роки (2019–2021 рр.).
3. В умовах війни в Україні зареєстровано збільшення частоти АІТ і кіст ЩЗ серед підлітків із ЦД1.
4. Дотримання рекомендацій щодо профілактики й лікування тиреоїдної дисфункції сприяє позитивній динаміці в стані тиреоїдної системи навіть у несприятливих умовах воєнного часу.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів і власної фінансової зацікавленості при підготовці даної статті.
Інформація про фінансування. Робота виконана в рамках планової наукової теми ДУ «ІОЗДП НАМН» — «Дослідити особливості перебігу хронічних неінфекційних захворювань у підлітків в умовах війни і повоєнного часу та удосконалити систему їхньої медико-психологічної реабілітації» (номер державної реєстрації 0120U104920).
Отримано/Received 11.05.2024
Рецензовано/Revised 13.06.2024
Прийнято до друку/Accepted 20.06.2024
Список литературы
1. Tsigos С, Chrousos GP. J Psychosom Res. 2002;4(53):865-871.
2. Nadolnik LI. Biomedical Chemistry. 2010;4(56):443-456.
3. Hughes JW, Riddlesworth TD, DiMeglio LA et al. J Clin Endocrinol Metab. 2016;101(12):4931-4937. doi: 10.1210/jc.2016-2478.
4. Budrejko OA. Probl Endocr Pathol. 2007;1:39-46.
5. МОЗ України. Стандарти медичної допомоги «Цукровий діабет у дітей»: Наказ МОЗ України № 413 від 28.02.2023.
6. Child Endocrinology: Protocols on medical assistance to children for the specialty. Kyiv, 2006: 94 p.
7. Турчина С.И., Начетова T.A., Кашкалда Д.A. Современная педиатрия. 2016;76(5):113-116. https://doi.оrg/10.15574/SP.2016.76.113.
8. Костенко T.П. Український журнал дитячої ендокринології. 2022;43–44(3–4):21-26. https://doi.оrg/10.30978/UJPE2022-3-4-21.
9. Турчина С.I., Косовцова Г.В., Костенко Т.П. та ін. Український журнал дитячої ендокринології. 2023;47–48(3–4):4-13. https://doi.org/10.30978/UJPE 2023-3-4-4.
10. Turchina SI, Kostenko TP, Nikitina LD et al. Probl Endocr Pathol. 2023;80(2):50-56. https://doi.org/10.21856/j-PEP.2023.2.06.
11. Assessment of iodine deficiency disorders and monitoring their elimination: А guide for programme managers. World Health Organization. 2007: 180 р. http://whqlibdoc.who.int/publications/2007/9789241595827eng.pdf, accessed 13 Oct 2016.
12. Biondi B, Wartofsky L. Endocrine Reviews. 2014;35(3):433-512. https://doi.org/10.1210/er.2013-1083.
13. Інструкція для медичного застосування препарату L-ТИРОК–СИН 50/75/100/125/150 БЕРЛІН-ХЕМІ від 12.10.2020 № 2313.

/25.jpg)