Журнал «Здоровье ребенка» Том 19, №4, 2024
Вернуться к номеру
Особливості грудного періоду в передчасно народжених дітей (клінічний випадок)
Авторы: L.M. Bulat, O.V. Lysunets, N.V. Didyk
Vinnytsya National Pirogov Memorial Medical University, Vinnytsia, Ukraine
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
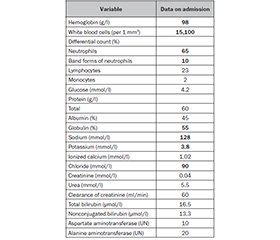
Лікарі загального профілю часто стикаються з передчасно народженими дітьми та несприятливими наслідками захворювань, пов’язаних із недоношеністю. Переривання внутрішньоутробного розвитку викликає значущі порушення будови й функції внутрішніх органів, що може призвести до ендотеліальної дисфункції, гіпертензії, протеїнурії та метаболічних аномалій, які зберігаються протягом усього життя. Діти, народжені передчасно, або немовлята з низькою масою тіла при народженні також мають відносно підвищений ризик розвитку пошкодження нирок у майбутньому. Часто ці немовлята лікуються у відділеннях інтенсивної терапії через гіпоксичне ураження або реакцію запалення, це також впливає на нирки, що змушує використовувати нефротоксичні препарати. Результати лікування й діагностики були застосовані, щоб зробити висновок про клінічні особливості недоношеної 7-місячної дівчинки. Дані проаналізовані за допомогою баз даних PubMed/MEDLINE та Google Scholar. Метою статті є узагальнення особливостей періоду грудного віку в дитини з низькою масою тіла, надання лікарям практичної інформації щодо організації подальшого спостереження. Матеріали та методи. Дитина народилася помірно передчасно (32–33 тижні вагітності) з низькою масою тіла (2100 г). Породілля була консультована з приводу гіпертензії та загрози переривання вагітності. У дитини в неонатальному періоді діагностовано транзиторні стани нирок. Оцінка за шкалою Апгар була низькою, проводилися реанімаційні заходи з респіраторною підтримкою з постійним позитивним тиском на видиху. Новонароджена дитина погано утримувала тепло, залежала від температури навколишнього середовища та була схильною до тепловтрати, тому виходжувалася в кювезі. Було налагоджене вигодовування через зонд, незважаючи на погане смоктання в перші дні після пологів, і при першій можливості грудне вигодовування продовжили. Згодом дитину почали годувати сумішшю. Результати. Після перенесеної інфекції верхніх дихальних шляхів у 7-місячної дитини з’явилися лихоманка, блювання, зневоднення, втрата маси тіла та олігурія. При обстеженні виявлені стигми, затримка нервового розвитку, відставання у фізичному розвитку. Аналіз крові встановив анемію І стадії та стрімке підвищення рівня лейкоцитів зі зсувом лейкоцитарної формули вліво й електролітними порушеннями. Лабораторні показники первинного та вторинного гемостазу в нормі. Фізичні, хімічні, а також мікроскопічні властивості сечі були змінені відповідно до результатів її аналізу. При ультразвуковому дослідженні виявлені зміни ниркової тканини та гіперплазія тимуса. У дитини діагностовано гострий пієлонефрит та проведено лікування. Висновки. Лікарі повинні звернути увагу на стигми, затримку нервового розвитку, відставання у фізичному розвитку, дані анамнезу життя, клінічні ознаки та результати обстеження, щоб своєчасно зробити висновок про загальний стан дитини. У передчасно народжених із низькою масою тіла може бути діагностовано пошкодження нирок.
Background. General physicians often encounter preterm infants and adverse sequelae of prematurity-related morbidities. Interruption of intrauterine development leads to considerable deficits in the internal organs structure and function. It can lead to endothelial dysfunction, hypertension, proteinuria and metabolic abnormalities that persist throughout life. Children born early or low birth weight (LBW) infants also have relatively increased risk for the development of kidney injury later in life. Often these infants have history of treatment at the intensive care unit due to hypoxic damage or inflammatory response that also affects kidneys necessitating the use of nephrotoxic medications. The treatment and diagnosis outcomes were applied to make a conclusion about clinical features of the preterm 7-month-old girl. The data were analyzed using PubMed/MEDLINE and Google Scholar databases. The aim is to summarize particulars of breastfeeding period in a LBW baby, providing a physician with practical information regarding organization of a follow-up. Material and methods. The baby was moderately preterm (32–33 weeks of gestation) with LBW (2100 g). Her mother was consulted regarding hypertension and threat of miscarriage during pregnancy. The child had renal borderline states in the newborn period. Apgar score was low, neonatal resuscitation and respiratory support by the continuous positive airway pressure were used. The newborn had poor regulation of body temperature, depended on environmental factors and prone to rapid heat loss, so she was nursed in incubator. A feeding tube was used despite poor sucking at the first days after delivery and breastfeeding was continued as soon as possible. Eventually, formula feeding was started. Results. Fever, vomiting, dehydration, loss of body weight and oliguria appeared in the 7-month-old baby after the upper respiratory tract infection. Examination showed the stigmas, neurodevelopmental delay, physical growth gap. Blood tests revealed anemia of the first stage and a rapid increase in the level of white blood cells with a left shift and electrolyte imbalance. The laboratory tests of primary and secondary hemostasis were normal. Physical, chemical and microscopic urine properties were changed according to results of urine test. The sonography revealed changes in renal tissue and thymic hyperplasia. The child was diagnosed with acute pyelonephritis and treated. Conclusions. Physicians should focus attention on the stigmas, neurodevelopmental delay, physical growth gap, life history, clinical signs and results of examination to make timely conclusion about child’s general state. Kidney injury could be diagnosed in preterm LBW infants.
ниркові розлади; недоношена дитина; грудний вік
kidney disorders; preterm infant; breastfeeding age
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Alipour A., Hantoushzadeh S., Hessami K. et al. A global study of the association of cesarean rate and the role of socioeconomic status in neonatal mortality rate in the current century. BMC Pregnancy Childbirth. 2022. 22. 821. doi: 10.1186/s12884-022-05133-9.
- Balachandran L., Jacob L., Al Awadhi R., Yahya L.O., Catroon K.M. et al. Urinary Tract Infection in Pregnancy and Its Effects on Maternal and Perinatal Outcome: A Retrospective Study. Cureus. 2022. 14(1). e21500. doi: 10.7759/cureus.21500.
- Crump C. An overview of adult health outcomes after preterm birth. Early Human Development. 2020. 150. 105187. doi: 10.1016/j.earlhumdev.2020.105187.
- Cleto-Yamane T.L., Gomes C.L.R., Suassuna J.H.R., Nogueira P.K. Acute Kidney Injury Epidemiology in Pediatrics. Jornal Brasileiro de Nefrologia. 2019. 41(2). 275-283. doi: 10.1590/2175-8239-JBN-2018-0127.
- Dyson A., Kent A.L. The Effect of Preterm Birth on Renal Development and Renal Health Outcome. NeoReviews. 2019. 20(12). e725-e736. doi: 10.1542/neo.20-12-e725.
- Fanos V., Antonucci R., Zaffanello M. Nenatal Drug-Induced Nephrotoxicity: Old and Next Generation Biomarkers for Early Detection and Management of Neonatal Drug-Induced Nephrotoxicity, with Special Emphasis on uNGAL and on Metabolomics. Current Medicinal Chemistry. 2012. 19(27). 4595-4605. doi: 10.2174/092986712803306439.
- Fenton T.R., Kim J.H. A systematic review and meta-analysis to revise the Fenton growth chart for preterm infants. BMC Pediatrics. 2013. 13. 59. doi: 10.1186/1471-2431-13-59.
- GBD 2019 Antimicrobial Resistance Collaborators. Global mortality associated with 33 bacterial pathogens in 2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet (London, England). 2022. 400(10369). 2221-2248. doi: 10.1016/S0140-6736(22)02185-7.
- Gul R., Anwar Z., Sheikh M., Salamat A., Iqbal S. et al. Neonatal AKI profile using KDIGO guidelines: A cohort study in tertiary care hospital ICU of Lahore, Pakistan. Frontiers in Pediatrics. 2022. 10. 1040077. doi: 10.3389/fped.2022.1040077.
- Han L.Y., Xu X.J., Tong X.M., Zhang X., Liu J. et al. Effect of breastfeeding on the development of infection-related diseases during hospitalization in late preterm infants in 25 hospitals in Beijing, China. Chinese Journal of Contemporary Pediatrics. 2020. 22(12). 1245-1250 (in Chinese). doi: 10.7499/j.issn.1008-8830.2007065.
- Ingelfinger J.R., Kalantar-Zadeh K., Schaefer F., World Kidney Day Steering Committee. Averting the legacy of kidney disease: focus on childhood. Journal of Nephrology. 2016. 29(2). 137-142. doi: 10.1007/s40620-016-0270-0.
- Levey A.S. Defining AKD: The Spectrum of AKI, AKD, and CKD. Nephron. 2022. 146(3). 302-305. doi: 10.1159/000516647.
- Masalskienė J., Rudaitis Š., Vitkevič R., Čerkauskienė R., Dobilienė D., Jankauskienė A. Epidemiology of Chronic Kidney Disease in Children: A Report from Lithuania. Medicina (Kaunas, Lithuania). 2021. 57(2). 112. doi: 10.3390/medicina57020112.
- Minuth W.W. Action Plan for Prolongation of Nephrogenesis in Preterm and Growth Restricted Babies: Explore Ultrastructure of the Nephrogenic Zone, Identify a Molecular Target, Select a Viable Drug and Find a Path for Administration. Drug Research. 2018. 68(1). 5-16. doi: 10.1055/s-0043-113637.
- Minuth W.W. Shaping of the nephron — a complex, vulnerable, and poorly explored backdrop for noxae impairing nephrogenesis in the fetal human kidney. Molecular and Cellular Pediatrics. 2020. 7(1). 2. doi: 10.1186/s40348-020-0094-9.
- Muoneke V.U., Una A.F., Eke C.B., Anyanwu O.U. The Burden and Outcome of Pediatric Renal Admissions at the Federal Teaching Hospital Abakaliki: A 3-year Review (2011–2013). Annals of Medical and Health Sciences Research. 2016. 6(4). 243-250. doi: 10.4103/amhsr.amhsr_342_14.
- Natarajan G., Shankaran S. Short- and Long-Term Outcomes of Moderate and Late Preterm Infants. American Journal of Perinatology. 2016. 33(3). 305-317. doi: 10.1055/s-0035-1571150.
- Pisani F., Spagnoli C., Facini C. Seizures in preterm newborns. Minerva Pediatrica. 2018. 70(1). 105-107. doi: 10.23736/S0026-4946.16.04742-3.
- Recommendations for management of common childhood conditions. Available from: https://www.who.int/publications/i/item/9789241502825.
- Snyers D., Lefebvre C., Viellevoye R., Rigo V. Late preterm: high risk newborns despite appearances. Revue Medicale de Liege. 2020. 75(2). 105-110 (in French).
- Williams J.E., Pugh Y. The Late Preterm: A Population at Risk. Critical Care Nursing Clinics of North America. 2018. 30(4). 431-443. doi: 10.1016/j.cnc.2018.07.001.
- Womack L.S., Rossen L.M., Hirai A.H. Urban-Rural Infant Mortality Disparities by Race and Ethnicity and Cause of Death. American Journal of Preventive Medicine. 2020. 58(2). 254-260. doi: 10.1016/j.amepre.2019.09.010.