Журнал «Медицина неотложных состояний» Том 20, №8, 2024
Вернуться к номеру
Динаміка варіабельності ритму серця залежно від виду анестезії при пластиці гриж передньої черевної стінки
Авторы: Ушневич Ж.О. (1, 2), Гарбар М.О. (2)
(1) - Львівська обласна клінічна лікарня, м. Львів, Україна
(2) - Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
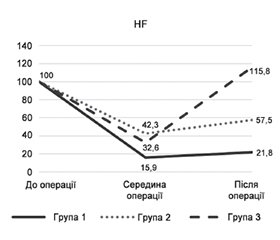
Актуальність. Неінвазивним методом аналізу відповіді цілісного організму на стрес хірургічного втручання є варіабельність ритму серця (ВРС). Адекватність реакції вегетативної нервової системи під час періопераційного періоду відображає як вихідні резерви організму, так і «фізіологічність» виду анестезії. ВРС використовується для прогнозу періопераційних ускладнень, особливо кардіальних, смертності, тривалості стаціонарного лікування. Метою дослідження було провести порівняльний аналіз динаміки ВРС на етапах хірургічного втручання залежно від виду анестезії пацієнтам під час планових операцій з приводу гриж передньої черевної стінки. Матеріали та методи. Обстежено та проліковано 91 пацієнта з грижами передньої черевної стінки. Пацієнтів поділено на 3 групи за методом анестезії (загальна, нейракcіальна та регіонарні блокади). Пацієнтам проведено добовий моніторинг ЕКГ з оцінкою ВРС. Зміни ВРС оцінювались у динаміці протягом операції. Для аналізу обрали динаміку 30 інтервалів по 5 хв, сумарно 2 год 30 хв. Моніторування умовно поділили на 3 етапи — початковий, основний і завершення операції. Результати. При проведенні загального знеболювання показники медіани індексів SDNN і pNN50 до кінця операції були вірогідно нижчі за вихідний рівень, а при регіонарному та нейроаксіальному знеболюванні або зросли порівняно з доопераційним рівнем, або повернулися до вихідних значень. У пацієнтів із загальним знеболюванням показники медіани LF/HF до кінця операції продовжували статистично вірогідно знижуватися, а при регіонарному та нейроаксіальному знеболюванні збільшилися та перевищили доопераційний рівень. У всіх пацієнтів разом зі зниженням загальної ВРС відбувалося зниження впливу як симпатичної, так і парасимпатичної ланок вегетативної нервової системи на кардіальний ритм. Але при проведенні загальної анестезії депресія ВРС утримувалася до кінця зворотного відрізку часу спостереження, на противагу пацієнтам з епідуральною анестезією та регіонарними блокадами, у яких спостерігалося зростання активності як симпатичної, так і парасимпатичної ланки до кінця операційного втручання. Висновки. Динаміка показників ВРС при використанні нейроаксіальних і регіонарних методів знеболювання відображає найбільш фізіологічну реакцію вегетативної нервової системи пацієнта з коморбідними станами при проведенні планового операційного лікування гриж передньої черевної стінки.
Background. Heart rate variability (HRV) is a non-invasive method of analyzing the response of the entire body to surgical stress. The adequacy of the autonomic nervous system response during the perioperative period involves both the initial reserves of the body and the physiology of anesthesia method. HRV is used to predict perioperative complications, especially cardiac ones, mortality, and duration of inpatient treatment. The purpose of the study was to perform a comparative analysis of the dynamics of heart rhythm variability at the stages of elective surgery for anterior abdominal wall hernias depending on the type of anesthesia. Materials and methods. Ninety-one patients with anterior abdominal wall hernias were examined and treated. They were divided into 3 groups according to the method of anesthesia (general, neuraxial and regional blockades). Patients underwent 24-hour ECG monitoring with assessment of HRV. Changes in HRV were evaluated during the surgery: the dynamics of 30 intervals of 5 minutes, a total of 2 hours and 30 minutes were chosen. The monitoring was conditionally divided into 3 stages — the initial, the main one, and the end of the surgery. Results. Under general anesthesia, the median SDNN and pNN50 by the end of the operation were significantly lower than the baseline. Under regional and neuraxial anesthesia, they increased compared to the preoperative level or returned to the baseline. In patients with general anesthesia, LF/HF median decreased statistically significantly until the end of the surgery, and under regional and neuraxial anesthesia, it increased and exceeded the preoperative level. In all patients, along with a decrease in total HRV, there was a reduction in the influence of both sympathetic and parasympathetic parts of the autonomic nervous system on cardiac rhythm. But in general anesthesia, HRV reduction was maintained until the end of the follow-up period, in contrast to patients with epidural anesthesia and regional blockades who reported an increase in both sympathetic and parasympathetic activity until the end of the surgical intervention. Conclusions. The dynamics of HRV during neuraxial and regional analgesia reflects the most physiological response of the autonomic nervous system of a patient with comorbid cardiovascular pathology during elective surgery for anterior abdominal wall hernias.
варіабельність ритму серця; хірургічне лікування гриж передньої черевної стінки; загальна анестезія; епідуральна анестезія; регіонарна анестезія
heart rate variability; surgical treatment for anterior abdominal wall hernias; general anesthesia; epidural anesthesia; regional anesthesia
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Watt DG, Horgan PG, McMillan DC. Routine clinical markers of the magnitude of the systemic inflammatory response after elective operation: a systematic review. Surgery. 2015 Feb;157(2):362-80. doi: 10.1016/j.surg.2014.09.009. PMID: 25616950.
- Manou-Stathopoulou V, Korbonits M, Ackland GL. Redefining the perioperative stress response: a narrative review. Br J Anaesth. 2019 Nov;123(5):570-583. doi: 10.1016/j.bja.2019.08.011. Epub 2019 Sep 20. PMID: 31547969.
- Alazawi W, Pirmadjid N, Lahiri R, Bhattacharya S. Inflammatory and Immune Responses to Surgery and Their Clinical Impact. Ann Surg. 2016 Jul;264(1):73-80. doi: 10.1097/SLA.0000000000001691. PMID: 27275778.
- Paola A., Carlo L., Cinzia D.R. Stress response to surgery, anaesthetics role and impact on cognition. J Anesth Clin Res. 2015;6:1-5.)
- Cusack B, Buggy DJ. Anaesthesia, analgesia, and the surgical stress response. BJA Educ. 2020 Sep;20(9):321-328. doi: 10.1016/j.bjae.2020.04.006. Epub 2020 Jul 21. PMID: 33456967; PMCID: PMC7807970.
- Wang XW, Cao JB, Lv BS, Mi WD, Wang ZQ, Zhang C, Wang HL, Xu Z. Effect of perioperative dexmedetomidine on the endocrine modulators of stress response: a meta-analysis. Clin Exp Pharmacol Physiol. 2015 Aug;42(8):828-36. doi: 10.1111/1440-1681.12431. PMID: 26016707.
- Máca J, Burša F, Ševčík P, Sklienka P, Burda M, Holub M. Alarmins and Clinical Outcomes After Major Abdominal Surgery — A Prospective Study. J Invest Surg. 2017 Jun;30(3):152-161. doi: 10.1080/08941939.2016.1231855. Epub 2016 Sep 30. PMID: 27689623.
- Fujiwara Y, Kurokawa S, Shibata Y, Asakura Y, Harado M, Komatsu T. Sympathovagal effects of spinal anaesthesia with intrathecal or intravenous fentanyl assessed by heart rate variability. Acta Anaesthesiol Scand. 2009 Apr;53(4):476-82. doi: 10.1111/j.1399-6576.2008.01800.x. Epub 2009 Feb 18. PMID: 19226297.
- Galletly DC, Westenberg AM, Robinson BJ, Corfiatis T. Effect of halothane, isoflurane and fentanyl on spectral components of heart rate variability. Br J Anaesth. 1994 Feb;72(2):177-80. doi: 10.1093/bja/72.2.177. PMID: 8110570.
- Nakatsuka I, Ochiai R, Takeda J. Changes in heart rate variability in sevoflurane and nitrous oxide anesthesia: effects of respiration and depth of anesthesia. J Clin Anesth. 2002 May;14(3):196-200. doi: 10.1016/s0952-8180(01)00384-1. PMID: 12031752.
- Jeanne M, Logier R, De Jonckheere J, Tavernier B. Heart rate variability during total intravenous anesthesia: effects of nociception and analgesia. Auton Neurosci. 2009 May 11;147(1-2):91-6.
- doi: 10.1016/j.autneu.2009.01.005. Epub 2009 Feb 8. PMID: 19201661.
- Reimer P, Máca J, Szturz P, Jor O, Kula R, Ševčík P, Burda M, Adamus M. Role of heart-rate variability in preoperative assessment of physiological reserves in patients undergoing major abdominal surgery. Ther Clin Risk Manag. 2017 Sep 19;13:1223-1231. doi: 10.2147/TCRM.S143809. PMID: 29033572; PMCID: PMC5614745.
- So V, Balanaser M, Klar G, Leitch J, McGillion M, Devereaux PJ, Arellano R, Parlow J, Gilron I. Scoping review of the association between postsurgical pain and heart rate variabi-lity parameters. Pain Rep. 2021 Dec 2;6(4):e977. doi: 10.1097/PR9.0000000000000977. PMID: 35155967; PMCID: PMC8824397.
- Anderson TA. Heart rate variability: implications for perioperative anesthesia care. Curr Opin Anaesthesiol. 2017 Dec;30(6):691-697. doi: 10.1097/ACO.0000000000000530. PMID: 28957877.
- Frandsen MN, Mehlsen J, Foss NB, Kehlet H. Preoperative heart rate variability as a predictor of perioperative outcomes: a systematic review without meta-analysis. J Clin Monit Comput. 2022 Aug;36(4):947-960. doi: 10.1007/s10877-022-00819-z. Epub 2022 Jan 29. PMID: 35092527; PMCID: PMC9293802.
- Koenig J, Jarczok MN, Ellis RJ, Warth M, Hillecke TK, Thayer JF. Lowered parasympathetic activity in apparently healthy subjects with self-reported symptoms of pain: preliminary results from a pilot study. Pain Pract. 2015 Apr;15(4):314-8. doi: 10.1111/papr.12177. Epub 2014 Feb 27. PMID: 24571545.
- Masel EK, Huber P, Engler T, Watzke HH. Heart rate variability during treatment of breakthrough pain in patients with advanced cancer: a pilot study. J Pain Res. 2016 Dec 12;9:1215-1220. doi: 10.2147/JPR.S120343. PMID: 28003771; PMCID: PMC5161332.
- Kim MK, Choi GJ, Oh KS, Lee SP, Kang H. Pain Assessment Using the Analgesia Nociception Index (ANI) in Patients Undergoing General Anesthesia: A Systematic Review and Meta-Analysis. J Pers Med. 2023 Oct 4;13(10):1461. doi: 10.3390/jpm13101461. PMID: 37888072; PMCID: PMC10608238.
- Reimer P, Máca J, Szturz P, Jor O, Kula R, Ševčík P, Burda M, Adamus M. Role of heart-rate variability in preoperative assessment of physiological reserves in patients undergoing major abdominal surgery. Ther Clin Risk Manag. 2017 Sep 19;13:1223-1231. doi: 10.2147/TCRM.S143809. PMID: 29033572; PMCID: PMC5614745.
- Heart rate variability: standards of measurement, physiological interpretation and clinical use. Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology. Circulation. 1996 Mar 1;93(5):1043-65. PMID: 8598068.
- Холтерівське та фрагментарне моніторування ЕКГ. Жарінов О.Й, Куць В.О., Сороківський М.С., Черняга-Ройко У.П. Львів: Медицина світу, 2010. 128 с.
- Heart rate variability: implications for perioperative anesthesia care. Thomas Anthony Anderson. Curr Opin Anaesthesiol. 2017 Dec;30(6):691-697.
- Comparison of the effects of propofol and midazolam on the cardiovascular autonomic nervous system during combined spinal and epidural anesthesia. S. Hidaka, M. Kawamoto, S. Kurita, O. Yuge. J Clin Anesth. 2005 Feb;17(1):36-43. doi: 10.1016/j.jclinane.2004.03.012.
- Pain/analgesia evaluation using heart rate variability analysis. R. Logier, M. Jeanne, B. Tavernier, J. De Jonckheere. Conf Proc IEEE Eng Med Biol Soc. 2006;1:4303-4306.
- Koenig J, Jarczok MN, Ellis RJ, Hillecke TK, Thayer JF. Heart rate variability and experimentally induced pain in healthy adults: a systematic review. Eur J Pain. 2014 Mar;18(3):301-14. doi: 10.1002/j.1532-2149.2013.00379.x. Epub 2013 Aug 6. PMID: 23922336.
- Альбокрiнов А.А., Фесенко У.А. Варіабельність серцевого ритму за різних видів регіонарної анестезії передньої черевної стінки у дітей. Pain, Anaesthesia & Intensive Care. 3(72):24-29. https://doi.org/10.25284/2519-2078.3(72).2015.84579].
- Song IKJS, Kim EH, Lee JH, et al. Heart rate variability may be more useful than pulse transit time for confirming successful caudal block under general anesthesia in children. Anesthesiol Pain Med. 2017;12:7.
- Issa R, Julien M, Decary E, et al. Evaluation of the analgesia nociception index (ANI) in healthy awake volunteers. Can J Anaesth 2017;64:828-835.
- Jess G, Pogatzki-Zahn EM, Zahn PK, Meyer-Friessem CH. Monitoring heart rate variability to assess experimentally induced pain using the analgesia nociception index: a randomised volunteer study. Eur J Anaesthesiol. 2016;33:118-125.
- Boselli E, Bouvet L, Begou G, et al. Prediction of immediate postoperative pain using the analgesia/nociception index: a prospective observational study. Br J Anaesth. 2014;112:715-721.
- The prognostic value of intraoperative HRV during anesthesia in patients presenting for non-cardiac surgery. Jiahe Niu, Yonghao Lu, Ruikun Xu, Fang Fang, Shikai Hong, Lexin Huang, et al. BMC Anesthesiol. 2023 May 9;23(1):160. doi: 10.1186/s12871-023-02118-9.023-02118.