Журнал «Медицина неотложных состояний» Том 21, №1, 2025
Вернуться к номеру
Аналіз впливу енісаміуму йодиду на клінічний перебіг гострих респіраторних вірусних інфекцій, грипу і COVID-19 в амбулаторних пацієнтів
Авторы: Голубовська О.А., Чалий К.О., Безродна О.В., Голубовська А.О. та ін.*
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
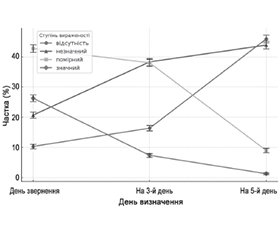
Актуальність. Гострі респіраторні вірусні інфекції (ГРВІ) в загальній структурі інфекційної патології посідають перше місце і залишаються критичною проблемою систем охорони здоров’я. Збудники ГРВІ здатні швидко поширюватися серед людей, ставати стійкими до противірусних препаратів, спричиняти тяжкі захворювання та пов’язані з вторинними ускладненнями. Метою роботи було проаналізувати ефективність застосування препарату енісаміум йодид у лікуванні амбулаторних пацієнтів із встановленим діагнозом гострої респіраторної вірусної інфекції, грипу або COVID-19 шляхом вивчення динаміки основних клінічних проявів захворювання. Матеріали та методи. Під час дослідження був проведений масштабний набір амбулаторних пацієнтів (n = 6414) із встановленим діагнозом ГРВІ, грипу і COVID-19, яким у комплексному лікуванні призначався препарат енісаміум йодид з подальшим ретроспективним аналізом заповнених опитувальних листів. Були досліджені зміни вираженості таких клінічних проявів: біль у горлі, кашель, нежить і закладеність носа, задишка й утруднене дихання, температура тіла. В опитувальних листах будо застосовано 4 градації ступеня вираженості симптомів: відсутність ознаки, незначний ступінь вираженості ознаки, помірний ступінь вираженості ознаки та значний ступінь вираженості ознаки. Відповідні дані збиралися в день звернення до лікаря, а також на 3-й і 5-й день лікування. Результати. Згідно з отриманими результатами, найбільшу частку серед захворювань пацієнтів (n = 6414) становили випадки ГРВІ — 82,51 % (95% ДІ: 81,58–83,44). COVID-19 діагностовано в 11,60 % пацієнтів (95% ДІ: 10,82–12,38), найменшу частку становили випадки грипу — 5,89 % (95% ДІ: 5,32–6,47). Частка хворих, у яких зникли скарги на біль у горлі на п’ятий день лікування, становила 67,59 проти 7,19 % у день звернення, абсолютне зростання на 60,40 % (95% ДІ: 58,59–62,14). Тотожні тенденції відзначені для всіх аналізованих клінічних проявів у зазначені інтервали спостереження: кашель — 45,87 проти 10,34 %, приріст на 35,53 % (95% ДІ: 33,55–37,47); задишка й утруднене дихання — 90,16 проти 55,83 %, абсолютне зростання на 34,33 % (95% ДІ: 32,37–36,25); нежить і закладеність носа — 48,89 проти 5,00 %, абсолютне зростання на 43,89 % (95% ДІ: 42,10–45,62); нормалізація температури тіла — 71,89 проти 1,67 %, абсолютне зростання на 70,22 % (95% ДІ: 68,76–71,59). Висновки. За результатами проведеного дослідження було відзначено високу ефективність застосування в лікуванні амбулаторних пацієнтів зі встановленим діагнозом ГРВІ, грипу або COVID-19 препарату енісаміум йодид. Аналіз основних клінічних симптомів (кашель, задишка й утруднене дихання, підвищення температури тіла, нежить і закладеність носа, біль у горлі) виявив статистично значуще поліпшення стану хворих вже на п’ятий день від початку терапії порівняно з першим днем звернення як за показником зниження вираженості окремого симптому, так і за його зникненням. Отже, отримані дані свідчать про високу клінічну ефективність препарату енісаміум йодид у зменшенні вираженості симптомів гострих респіраторних вірусних інфекцій.
Background. Acute respiratory viral infections (ARVI) rank first in the general structure of infectious pathology and remain a critical problem of healthcare systems. ARVI pathogens can spread rapidly among human population, become resistant to antiviral drugs, cause severe diseases and are associated with secondary complications. The purpose of the study was to analyse the effectiveness of enisamium iodide in the treatment of outpatients with an established diagnosis of acute respiratory viral infection, influenza or COVID-19 by studying the changes in the main clinical manifestations of the disease. Materials and methods. The study included a large-scale recruitment of outpatients (n = 6114) with an established diagnosis of acute respiratory viral infection, influenza and COVID-19, who were prescribed enisamium iodide as part of comprehensive treatment, with subsequent retrospective analysis of completed questionnaires. Changes in the severity of the following clinical manifestations were studied: sore throat, cough, runny nose and nasal congestion, shortness of breath and difficulty breathing, body temperature. The questionnaires used 4 gradations of symptom severity, including absence of symptoms, mild, moderate and significant severity of symptoms. The relevant data were collected on the day of the first consultation with a doctor, as well as on the third and fifth days of treatment. Results. According to the results obtained, the largest share of diseases was represented by cases of ARVI — 82.51 % (95% CI: 81.58–83.44). COVID-19 was diagnosed in 11.60 % of patients (95% CI: 10.82–12.38), the smallest share belonged to influenza — 5.89 % (95% CI: 5.32–6.47). The proportion of patients in whom complaints of sore throat disappeared on the fifth day of treatment was 67.59 versus 7.19 % on the day of the first visit, with an absolute increase of 60.40 % (95% CI: 58.59–62.14). Identical trends were observed for all analysed clinical manifestations in the indicated observation intervals: cough — 45.87 versus 10.34 %, an increase of 35.53 % (95% CI: 33.55–37.47); shortness of breath and difficulty breathing — 90.16 versus 55.83 %, an absolute increase of 34.33 % (95% CI: 32.37–36.25); runny nose and nasal congestion — 48.89 versus 5.00 %, an absolute increase of 43.89 % (95% CI: 42.10–45.62); normalization of body temperature — 71.89 versus 1.67 %, an absolute increase of 70.22 % (95% CI: 68.76–71.59). Conclusions. According to the results of the study, enisamium iodide was highly effective in the treatment of outpatients with a diagnosis of ARVI, influenza or COVID-19. Analysis of the main clinical symptoms (cough, shortness of breath and difficulty breathing, fever, runny nose and nasal congestion, sore throat) revealed a statistically significant improvement in the patients’ state already on the fifth day from the start of therapy compared to the first day, both in terms of reducing the severity of an individual symptom and its disappearance. Thus, the data obtained indicate the high clinical effectiveness of enisamium iodide in reducing the severity of symptoms of acute respiratory viral infections.
гострі респіраторні вірусні інфекції; COVID-19; грип; енісаміум йодид; лікування; динаміка клінічних проявів; респіраторні симптоми
acute respiratory viral infections; COVID-19; influenza; enisamium iodide; treatment; dynamics of clinical manifestations; respiratory symptoms
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Yang FF, Yu SJ, Du WN, Wang HM, Yao XX, Xue DD, Yu Y. Global morbidity and mortality of lower respiratory infections: A population-based study. Respiratory Medicine. 2022;205:107042. https://doi.org/10.1016/j.rmed.2022.107042.
- Tregoning JS, Schwarze J. Respiratory viral infections in infants: causes, clinical symptoms, virology, and immunology. Clinical Microbiology Reviews. 2010;23(1):74-98. https://doi.org/10.1128/CMR.00032-09.
- World Health Organization. The top 10 causes of death. Date last updated: 7 August 2024. Date last accessed: 12 February 2025. http://www.who.int/news-room/fact-sheets/detail/the-top-10-causes-of-death.
- Stambas J, Lu C, Tripp RA. Innate and adaptive immune responses in respiratory virus infection: implications for the clinic. Expert Review of Respiratory Medicine. 2020;14(11):1141-1147. https://doi.org/10.1080/17476348.2020.1807945.
- De Conto F, Conversano F, Medici MC, Ferraglia F, Pinardi F, Arcangeletti MC, Chezzi C, Calderaro A. Epidemiology of human respiratory viruses in children with acute respiratory tract infection in a 3-year hospital-based survey in Northern Italy. Diagnostic Microbiology and Infectious Disease. 2019;94(3):260-267. https://doi.org/10.1016/j.diagmicrobio.2019.01.008.
- Zappa A, Perin S, Amendola A, Bianchi S, Pariani E, Ruzza ML, Farina C. Epidemiological and molecular surveillance of influenza and respiratory syncytial viruses in children with acute respiratory infections (2004/2005 season). Microbiologia Medica. 2008;23(1).
- Hernandez-Vargas EA, Wilk E, Canini L, Toapanta FR, Bin-der SC, Uvarovskii A, et al. Effects of aging on influenza virus infection dynamics. Journal of Virology. 2014;88(8):4123-4131. https://doi.org/10.1128/JVI.03644-13.
- Ni L, Ye F, Cheng ML, Feng Y, Deng YQ, Zhao H, et al. Detection of SARS-CoV-2-Specific Humoral and Cellular Immunity in COVID-19 Convalescent Individuals. Immunity. 2020;52(6):971-977.e3. https://doi.org/10.1016/j.immuni.2020.04.023.
- Santos Coy-Arechavaleta A, Alvarado-Yaah JE, Uribe-Noguez LA, Guerra-Castillo FX, Santacruz-Tinoco CE, Ramón-Galle-
- gos E, et al. Relationship between the Viral Load in Patients with Different COVID-19 Severities and SARS-CoV-2 Variants. Microorganisms. 2024;12(3):428. https://doi.org/10.3390/microorganisms12030428.
- Metz C, Schmid A, Veldhoen S. Increase in complicated upper respiratory tract infection in children during the 2022/2023 winter season — a post coronavirus disease 2019 effect? Pediatric Radiology. 2024;54(1):49-57. https://doi.org/10.1007/s00247-023-05808-1.
- Zarur-Torralvo S, Stand-Niño I, Flórez-García V, Mendoza H, Viana-Cárdenas E. Viruses responsible for acute respiratory infections before (2016–2019) and during (2021) circulation of the SARS-CoV-2 virus in pediatric patients in a reference center at Barranquilla Colombia: A pattern analysis. Journal of Medical Virology. 2023;95(1):e28439. https://doi.org/10.1002/jmv.28439.
- Taylor A, Whittaker E. The Changing Epidemiology of Respiratory Viruses in Children During the COVID-19 Pandemic: A Canary in a COVID Time. The Pediatric Infectious Disease Journal. 2022;41(2):e46-e48. https://doi.org/10.1097/INF.0000000000003396.
- Paget J, Spreeuwenberg P, Charu V, Taylor RJ, Iuliano AD, Bresee J, Simonsen L, Viboud C; Global Seasonal Influenza-associated Mortality Collaborator Network and GLaMOR Collaborating Teams. Global mortality associated with seasonal influenza epidemics: New burden estimates and predictors from the GLaMOR Project. Journal of global health. 2019;9(2):020421. https://doi.org/10.7189/jogh.09.020421.
- World Health Organization 2023 data.who.int, WHO Coronavirus (COVID-19) dashboard > Cases [Dashboard]. https://data.who.int/dashboards/covid19/cases.
- Geoghegan S, Erviti A, Caballero MT, Vallone F, Zanone SM, Losada JV, et al. Mortality due to Respiratory Syncytial Virus. Burden and Risk Factors. American Journal of Respiratory and Critical Care Medicine. 2017;195(1):96-103. https://doi.org/10.1164/rccm.201603-0658OC.
- Daoud A, Laktineh A, Macrander C, Mushtaq A, Soubani AO. Pulmonary complications of influenza infection: a targeted narrative review. Postgraduate Medicine. 2019;131(5):299-308.
- Obando-Pacheco P, Justicia-Grande AJ, Rivero-Calle I, Rodríguez-Tenreiro C, Sly P, Ramilo O, et al. Respiratory syncytial virus seasonality: a global overview. The Journal of Infectious Diseases. 2018;217(9):1356-1364.
- Russell CJ, Penkert RR, Kim S, Hurwitz JL. Human metapneumovirus: a largely unrecognized threat to human health. Pathogens. 2020;9(2):109.
- Інформаційний бюлетень за 6 тижнів 2025 року. Центр громадського здоров’я МОЗ України. Захворюваність на грип та ГРВІ в Україні. 11.02.2025. https://phc.org.ua/sites/default/files/users/user92/%D0%91%D1%8E%D0%BB%D0%B5%D1%82%D0%B5%D0%BD%D1%8C%2C%2006%20%D1%82%D0%B8%D0%B6%D0%B4%D0%B5%D0%BD%D1%8C%202025.pdf (дата звернення: 13.02.2025).
- Bradley BT, Bryan A. Emerging respiratory infections: the infectious disease pathology of SARS, MERS, pandemic influenza, and Legionella. Seminars in diagnostic pathology. (2019 May;36(3):152-159).
- Holubovska O, Babich P, Mironenko A, Milde J, Lebed Y, Stammer H, et al. RNA Polymerase Inhibitor Enisamium for Treatment of Moderate COVID-19 Patients: A Randomized, Placebo-Controlled, Multicenter, Double-Blind Phase 3 Clinical Trial. Advances in Respiratory Medicine. 2024;92(3):202-217. https://doi.org/10.3390/arm92030021.
- Walker AP, Fan H, Keown JR, Margitich V, Grimes JM, Fodor E, Te Velthuis AJW. Enisamium is a small molecule inhibitor of the influenza A virus and SARS-CoV-2 RNA polymerases.
- bioRxiv: the Preprint Server for Biology. 2020.04.21.053017. https://doi.org/10.1101/2020.04.21.053017.
- Te Velthuis AJW, Zubkova TG, Shaw M, Mehle A, Boltz D, Gmeinwieser N et al. Enisamium Reduces Influenza Virus Shedding and Improves Patient Recovery by Inhibiting Viral RNA Polymerase Activity. Antimicrobial Agents and Chemotherapy. 2021;65(4):e02605-20. https://doi.org/10.1128/AAC.02605-20.