Международный неврологический журнал Том 21, №1, 2025
Вернуться к номеру
Оцінка нейромодуляторних ефектів при тривалому курсі лікування цитиколіном у пацієнтів з хворобою дрібних судин головного мозку
Авторы: Боженко Н.Л.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
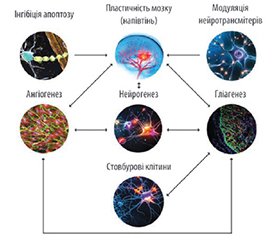
Актуальність. Хвороба дрібних судин головного мозку (ХДС ГМ) є поширеною патологією, яка виникає внаслідок пошкодження дрібних судин головного мозку, що призводить до його хронічної ішемії. ХДС ГМ пов’язана із 25 % випадків ішемічних інсультів і 45 % — судинної деменції. Основними симптомами ХДС ГМ є порушення пам’яті, розлади уваги, перепади настрою, порушення ходи, нервово-психічні розлади. Фармакологічні підходи до лікування ХДС ГМ залишаються недостатньо вивченими і базуються на обмеженій кількості досліджень низької якості. Цитиколін є нейропротекторним засобом, що використовується для поліпшення когнітивних функцій і підтримки структури нейронів. Як прекурсор фосфатидилхоліну він сприяє стабілізації клітинних мембран, зменшенню ішемічного пошкодження й підтримує структурну цілісність нейронів. Крім того, препарат стимулює синтез ацетилхоліну, важливого нейромедіатора в процесах пам’яті та навчання. Кілька досліджень і метааналізів продемонстрували позитивний вплив цитиколіну на когнітивні, емоційні та поведінкові розлади, які часто асоціюються з ХДС ГМ, що робить цей препарат перспективним засобом у терапії цієї патології. Нещодавно в Україні зареєстровано новий препарат цитиколіну у формі перорального розчину — Нейроцитин® С 200 мл. Для оцінки його клінічної ефективності при тривалому (20-денному) застосуванні в осіб із ураженням дрібних судин головного мозку розпочинається популяційне дослідження «Оцінка нейромодуляторних ефектів під час тривалого лікування цитиколіном у пацієнтів із ХДС ГМ». Мета: підтвердити клінічну ефективність і безпеку тривалого застосування препарату Нейроцитин® С у лікуванні пацієнтів із хронічними цереброваскулярними порушеннями (хворобою дрібних судин головного мозку). Матеріали та методи. Це клінічне дослідження проводиться як багатоцентрове післяреєстраційне обсерваційне (неінтервенційне) відкрите непорівняльне клінічне. Пацієнти проходитимуть комплексні, клінічні та параклінічні обстеження. Усі вони отримають найкраще лікування відповідно до національних рекомендацій і стандартів, затверджених Міністерством охорони здоров’я під час дослідження. Популяція пацієнтів. Особи з хронічними цереброваскулярними порушеннями (хворобою дрібних судин головного мозку) будуть включені в дослідження в окремих центрах України. Критерії ефективності та змінні. Основною змінною є зменшення інтенсивності симптомів або їх зникнення і поліпшення загального стану пацієнта. Первинні кінцеві точки ефективності досліджуваного препарату. Первинною кінцевою точкою є обстеження за допомогою госпітальної шкали тривоги й депресії та Монреальської шкали оцінки когнітивних функцій, яке лікар проводитиме амбулаторно для підвищення рівня доказовості препарату Нейроцитин® С до та після терапії. Вторинні кінцеві точки ефективності досліджуваного препарату. Вторинними кінцевими точками є ефективність втручання та безпека, переносимість препарату; зміни супутньої симптоматики. Висновки. Хвороба дрібних судин головного мозку є поширеною патологією. Фармакологічні підходи до її лікування залишаються недостатньо вивченими та базуються на обмеженій кількості випробувань низької якості. Дослідження показали, що застосування цитиколіну у відповідних дозах добре переноситься та зменшує вираженість когнітивних, емоційних і поведінкових розладів, які є характерними симптомами ХДС ГМ. Вивчення ефективності, безпеки та переносимості препарату Нейроцитин® С у лікуванні пацієнтів із хворобою дрібних судин головного мозку сприятиме розумінню ролі нейропротекторної терапії в перебігу цієї патології.
Background. Cerebral small vessel disease (CSVD) is a common pathology resulting from damage to small cerebral vessels, leading to chronic brain ischemia. CSVD is associated with 25 % of ischemic strokes and 45 % of vascular dementia cases. The main symptoms of CSVD include memory impairment, attention deficits, mood swings, gait disturbances, and neuropsychiatric disorders. Pharmacological approaches to treating CSVD are poorly studied and based on a limited number of low-quality studies. Citicoline is a neuroprotective agent used to improve cognitive functions and support neuronal structure. As a precursor of phosphatidylcholine, it helps stabilize cell membranes, reduce ischemic damage, and maintain neuronal structural integrity. It also stimulates the synthesis of acetylcholine, an important neurotransmitter in memory and learning processes. Several studies and meta-analyses have demonstrated the positive effects of citicoline on cognitive, emotional, and behavioral disorders which are often associated with CSVD. This makes citicoline a promising agent for CSVD therapy. Recently, a new citicoline preparation in the form of an oral solution, Neurocitin® C 200 ml, was registered in Ukraine. To assess its clinical efficacy during long-term (20-day) use in patients with cerebral small vessel disease, a population study titled “Evaluation of neuromodulatory effects during long-term citicoline treatment in patients with CSVD” is starting. Objective: to confirm the clinical efficacy and safety of long-term use of Neurocitin® C in the treatment of patients with chronic cerebral vascular disorders (cerebral small vessel disease). Materials and methods. This clinical study is conducted as a multicenter post-registration observational (non-interventional) open-label non-comparative clinical trial. Patients undergo multimodal, clinical, and paraclinical examinations. All patients receive the best standard medical management according to national guidelines and standards approved by the Ministry of Health at the time of the study. Patient population. Patients with chronic cerebral vascular disorders (cerebral small vessel disease) will be included in selected centers in Ukraine. Efficacy criteria and variables. The main variable is the reduction in symptom intensity or cessation, and improvement in the overall condition. Primary efficacy endpoints of the investigational drug. The primary endpoint is the examination using the Hospital Anxiety and Depression Scale and Montreal Cognitive Assessment, conducted by a physician in outpatient practice to increase the level of evidence for Neurocitin® C before and after the therapy. Secondary efficacy endpoints of the investigational drug. The secondary endpoints were efficacy of the intervention and safety, tolerability of the drug; changes in concomitant symptoms. Conclusions. Cerebral small vessel disease is a common pathology. Pharmacological approaches to treating CSVD are poorly studied and based on a limited number of low-quality research. Studies have shown that the use of citicoline in appropriate doses is well tolerated and reduces the severity of cognitive, emotional, and behavioral disorders, which are common symptoms of CSVD. The study of the efficacy, safety, and tolerability of Neurocitin® C in the treatment of patients with cerebral small vessel disease will improve understanding of the role of neuroprotective therapy in the course of this pathology.
хвороба дрібних судин головного мозку; цитиколін; когнітивні порушення; нейропротекція; Нейроцитин® С; деменція; нейрозапалення; реабілітація
cerebral small vessel disease; citicoline; cognitive impairment; neuroprotection; Neurocitin® C; dementia; neuroinflammation; rehabilitation
Обґрунтування
/52.jpg)
Матеріали та методи
Висновок
- Singh A., Bonnell G., De Prey J., et al. (2023) Small-vessel disease in the brain. Am. Heart J. Plus. 18;27:100277. doi: 10.1016/j.ahjo.2023.100277.
- Losso M., Wang J.Y., Wilson M. (2024) 10 Things You Should Know About Cerebral Small Vessel Disease. Stroke. May;55(5):e140-e143. doi: 10.1161/STROKEAHA.123.045102.
- Markus H.S., de Leeuw F.E. (2023) Cerebral small vessel disease: Recent advances and future directions. Int. J. Stroke. 18(1):4-14. doi: 10.1177/17474930221144911.
- Gao Y., Li D., Lin J., et al. (2022) Cerebral small vessel disease: Pathological mechanisms and potential therapeutic targets. Front Aging. Neurosci. Aug 12;14:961661. doi: 10.3389/fnagi.2022.961661.
- Paolini Paoletti F., Simoni S., Parnetti L., et al. (2021) The Contribution of Small Vessel Disease to Neurodegeneration: Focus on Alzheimer’s Disease, Parkinson’s Disease and Multiple Sclerosis. International Journal of Molecular Sciences. 22(9):4958. doi.org/10.3390/ijms22094958.
- Wardlaw J.M., Debette S., Jokinen H., et al. (2021) ESO Guideline on covert cerebral small vessel disease. European Stroke Journal. 6(2):CXI-CLXII. doi: 10.1177/23969873211012132.
- Wardlaw J.M., Smith C., Dichgans M. (2019) Small vessel disease: mechanisms and clinical implications. Lancet Neurol. 18(7):684-696.
- Grosset L., Jouvent E. (2022) Cerebral Small-Vessel Diseases: A Look Back from 1991 to Today. Cerebrovasc. Dis. 51(2):131-137. doi: 10.1159/000522213.
- Литвин Е.В., Кравченко А.М., Черний Т.В. (2016) Особливості церебральної гемодинаміки в осіб працездатного віку з дисциркуляторною енцефалопатією. Український медичний часопис. http://www.umj.com.ua/uk/publikatsia-95034-osoblivosti-cerebralnoi-gemodinamiki-v-osib-pracezdatnogo-viku-z-discirkulyatornoyu-encefalopatiyeyu.
- Wardlaw J.M., Smith E.E., Biessels G.J., et al. (2013) Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration. Lancet Neurol. 12(8):822-38.
- Wardlaw J.M., Chabriat H., de Leeuw F.-E., et al. (2024) European stroke organisation (ESO) guideline on cerebral small vessel disease, part 2, lacunar ischaemic stroke. European Stroke Journal. 9(1):5-68. doi: 10.1177/23969873231219416.
- Fanning J.P., Wong A.A., Fraser J.F. (2014) The epidemiology of silent brain infarction: a systematic review of population-based cohorts. BMC Med. 12:119. doi.org/10.1186/s12916-014-0119-0.
- Smith E., Saposnik G., Biessels G.J., et al. (2017) American Heart Association Stroke Council; Council on Cardiovascular Radiology and Intervention; Council on Functional Genomics and Translational Biology; and Council on Hypertension. Prevention of stroke in patients with silent cerebrovascular disease: A scientific statement for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 48(2):e44-e71. doi: 10.1161/STR.0000000000000116.
- Lam B.Y.K., Cai Y., Akinyemi R., et al. (2023) The global burden of cerebral small vessel disease in low- and middle-income countries: A systematic review and meta-analysis. Int. J. Stroke. Jan; 18(1):15-27. doi: 10.1177/17474930221137019.
- Larson B.A., Stockwell D., Boas S., et al. (2012) Cardiac reactive oxygen species after traumatic brain injury. J. of Surgical. Research. 173(2):e73-81.
- Villalba N., Sackheim A., Nunez I., et al. (2017) Traumatic brain injury causes endothelial dysfunction in the systemic microcirculation through arginase-1-dependent uncoupling of endothelial nitric oxide synthase. Journal of Neurotrauma. 1;34(1):192-203.
- Cannistraro R.J., Badi M., Eidelman B.H., et al. (2019) CNS small vessel disease: A clinical review. Neurology. Jun 11;92(24):1146-1156. doi: 10.1212/WNL.0000000000007654.
- Zanon Zotin M.C., Sveikata L., Viswanathan A., et al. (2021) Cerebral small vessel disease and vascular cognitive impairment: from diagnosis to management. Curr. Opin. Neurol. Apr 1;34(2):246-257. doi: 10.1097/WCO.0000000000000913.
- Elahi F.M., Wang M.M., Meschia J.F. (2023) Cerebral Small Vessel Disease-Related Dementia: More Questions Than Answers. Stroke. Mar; 54(3):648-660. doi: 10.1161/STROKEAHA.122.038265. Epub 2023 Feb 27. PMID: 36848423; PMCID: PMC10357466.
- Nam K.W., Kwon H.M., Lim J.S., et al. (2017) The presence and severity of cerebral small vessel disease increases the frequency of stroke in a cohort of patients with large artery occlusive disease. PLoS One. 12:e0184944.
- Backhouse E.V., Boardman J.P., Wardlaw J.M. (2024) Cerebral Small Vessel Disease: Early-Life Antecedents and Long-Term Implications for the Brain, Aging, Stroke, and Dementia. Hypertension. 81(1):54-74. doi: 10.1161/HYPERTENSIONAHA.122.19940.
- Ganesh A., Gutnikov S.A., Rothwell P.M.; Oxford Vascular Study (2018). Late functional improvement after lacunar stroke: a po-pulation-based study. J. Neurol. Neurosurg. Psychiatry. 89(12):1301-1307. doi: 10.1136/jnnp-2018-318434.
- Wilson D., Hostettler I.C., Ambler G., et al. (2017) Convexity subarachnoid haemorrhage has a high risk of intracerebral haemorrhage in suspected cerebral amyloid angiopathy. J. Neurol. 264:664-673.
- Shi Y., Wardlaw J.M. (2016) Update on cerebral small vessel disease: a dynamic whole-brain disease. Stroke Vasc. Neurol. Oct 25;1(3):83-92. doi: 10.1136/svn-2016-000035.
- Reaume N., Reid M., Tadros G.S., et al. (2023) The relationship of small vessel disease burden on cerebral and regional brain atrophy rates and cognitive performance over one year of follow-up after transient ischemic attack. Front. Neurol. Nov 24;14:1277765. doi: 10.3389/fneur.2023.1277765.
- Synoradzki K., Grieb P. (2019) Citicoline: A Superior Form of Choline? Nutrients. Jul 12;11(7):1569. doi: 10.3390/nu11071569.
- Rosell A., Barceló V., García-Bonilla L., et al. (2012) Neurorepair potencial of CDP-Choline alter cerebral ischemia in mice. Cerebrovasc. Dis. 33:419. doi: 10.1159/000335869.
- Alviarez E., Gonzalez M. (2007) Efectividad y tolerabilidad de la citicolina en el ictus isquémico agudo, estudio aleatorizado, doble ciego comparado con placebo. Archivos Venezolanos de Farmacologia y Terapéutica. 26:127-30.
- Sobrino T., Rodriguez-González R., Blanco M., et al. (2011) CDP-choline treatment increases circulating endothelial progenitor cells in acute ischemic stroke. Neurol. Res. 33:572-577. doi: 10.1179/016164110X12807570510176.
- Gutiérrez-Fernández M., Rodriguez-Frutos B., Fuentes B., et al. (2012) CDP-choline treatment induces brain plasticity markers expression in experimental animal stroke. Neurochem. Int. 60:310-317. doi: 10.1016/j.neuint.2011.12.015.
- Diederich K., Frauenknecht K., Minnerup J., et al. (2012) Citicoline enhances neuroregenerative processes after experimental stroke in rats. Stroke. 43:1931-1940. doi: 10.1161/STROKEAHA.112.654806.
- Alberghina M., Viola M., Serra I., et al. (1981) Effect of CDP-choline on the biosynthesis of phospholipids in brain regions during hypoxic treatment. J. Neurosci. Res. 6:421-33.
- Serra I., Alberghina M., Viola M., et al. (1981) Effects of CDP-choline on the biosynthesis of nucleic acids and proteins in brain regions during hypoxia. Neurochem. Res. 6:607-18.
- LePoncin-Lafitte M., Duterte D., et al. (1986) CDP-choline et accident cérébral expérimental día’origine vasculaire. Agressologie. 27:413-6.
- Drago F., Valerio C., D’Agata V., et al. (1989) Razionale farmacologico dell’impiego della CDP-colina nelle cerebrovasculopatie croniche. Ann. Ital. Med. Int. 4:261-7.
- Fioravanti M., Yanagi M. (2004) Cytidinediphosphocholine (CDP choline) for cognitive and behavioural disturbances associated with chronic cerebral disorders in the elderly. Cochrane Database Syst. Rev. 2:CD000269. doi: 10.1002/14651858.CD000269.pub2.
- Cotroneo A.M., Castagna A., Putignano S., et al. (2013) Effectiveness and safety of citicoline in mild vascular cognitive impairment: the IDEALE study. Clin. Interv. Aging. 8:131-7. doi: 10.2147/CIA.S38420.
- Alvarez-Sabín J., Ortega G., Jacas C., et al. (2013) Long-term treatment with citicoline may improve poststroke vascular cognitive impairment. Cerebrovasc. Dis. 35(2):146-54. doi: 10.1159/000346602.
- Alvarez-Sabín J., Santamarina E., Maisterra O., et al. (2016) Long-Term Treatment with Citicoline Prevents Cognitive Decline and Predicts a Better Quality of Life after a First Ischemic Stroke. Int. J. Mol. Sci. Mar 16;17(3):390. doi: 10.3390/ijms17030390.
- Орос М.М. (2024) Прогресивне лікування неврологічного дефіциту у пацієнтів з хворобою дрібних судин головного мозку. Укр. мед. часопис. 5(163):3-10. doi: 10.32471/umj.1680-3051.163.256386. Посилання: www.umj.com.ua/uk/publikatsia-256386-progresivne-likuvannya-nevrologichnogo-defitsitu-u-patsiyentiv-z-hvoroboyu-dribnih-sudin-golovnogo-mozku.

/53.jpg)