Журнал "Гастроэнтерология" Том 59, №1, 2025
Вернуться к номеру
Біохімічний склад рефлюксату в слині та шлунковому соку у хворих з неспроможністю фізіологічної кардії при грижах стравохідного отвору діафрагми в умовах воєнного стану
Авторы: Бабій О.М., Галінська А.М., Пролом Н.В., Галінський О.О.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
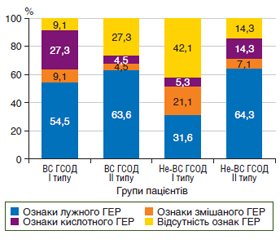
Актуальність. Грижа стравохідного отвору діафрагми (ГСОД) і неспроможність фізіологічної кардії призводять до змін біохімічного складу шлункового соку і слини, що впливає на перебіг рефлюксної хвороби і стан слизової оболонки. Дослідження біохімічних маркерів, таких як пепсин, жовчні кислоти, загальний кальцій і оксид азоту (NOx), дозволяє точніше діагностувати типи рефлюксу, оцінити ступінь ураження слизової оболонки, а також виявити особливості патогенезу захворювання у військовослужбовців (ВС) і не військовослужбовців (не-ВС), що сприятиме розробці оптимальних підходів до діагностики та лікування. Мета: оцінити біохімічний склад рефлюксату при грижах стравохідного отвору діафрагми в умовах воєнного стану шляхом дослідження слини та шлункового соку. Матеріали та методи. Дослідження проведено серед 66 пацієнтів з ГСОД, які були розподілені за типами ГСОД: 30 військовослужбовців: I тип — аксіальна ГСОД (n = 11) і II тип — параезофагеальна ГСОД (n = 19); 36 не-ВС: I тип — аксіальна ГСОД (n = 22) і II тип — параезофагеальна ГСОД (n = 14). Біохімічні дослідження слини та шлункового соку включали вимірювання рН, визначення концентрації пепсину, жовчних кислот, загального кальцію, NOx. Результати. У ВС із ГСОД спостерігалося зростання pH і зниження концентрації пепсину, що вказувало на гіпоацидність. У не-ВС при ГСОД I типу ці зміни були більш вираженими. Вміст жовчних кислот у шлунковому соку був підвищений у всіх групах, особливо у ВС із ГСОД II типу, що свідчило про лужний рефлюкс. У слині ВС спостерігалося значне збільшення концентрації жовчних кислот, що є ознакою агресивного рефлюксу, тоді як у не-ВС більш виражено змінювався рівень pH і знижувалася концентрація пепсину. Концентрація NOx у ВС при ГСОД II типу значно перевищувала контрольні значення, що свідчило про активні запальні процеси. Висновки. Отримані результати підтверджують, що в пацієнтів з неспроможністю фізіологічної кардії при ГСОД склад рефлюксату, механізми й особливості перебігу рефлюксної хвороби різнилися залежно від типу ГСОД і професійного статусу пацієнта. Лужний рефлюксат, висока концентрація оксиду азоту і загального кальцію є домінуючою ознакою при ГСОД II типу, особливо у ВС, тоді як кислотний рефлюксат частіше спостерігався у ВС із неспроможністю фізіологічної кардії при ГСОД I типу. Отримані дані вказують на необхідність індивідуального підходу до діагностики й лікування пацієнтів залежно від складу рефлюксату.
Background. A hiatal hernia (HH) and functional cardia insufficiency lead to changes in the biochemical composition of gastric juice and saliva, affecting the course of reflux disease and the condition of the mucous membrane. The study of biochemical markers such as pepsin, bile acids, total calcium, and nitric oxide (NOx) allows for a more accurate diagnosis of reflux types, assessment of the degree of mucosal damage, and identification of the diseases pathogenesis features in both military (MP) and non-military personnel (NMP). This will contribute to the development of optimal approaches to diagnosis and treatment. Objective: to assess the biochemical composition of refluxate in hiatal hernias under martial law conditions by examining saliva and gastric juice. Materials and methods. The study was conducted among 66 patients divided by the types of HH: 30 military personnel: type I — axial HH (n = 11), type II — paraesophageal HH (n = 19); and 36 NMP: type I — axial HH (n = 22), type II — paraesophageal HH (n = 14). Biochemical analyses of saliva and gastric juice included pH measurement, determination of pepsin, bile acids, total calcium, and NOx levels. Results. MP with HH had an increase in pH and a decrease in pepsin concentration, indicating hypoacidity. In NMP with HH type I, these changes were more pronounced. The content of bile acids in gastric juice was elevated in all groups, particularly in MP with HH type II, indicating alkaline reflux. A significant increase in bile acid concentration was observed in the saliva of MP, which is a marker of aggressive reflux, whereas in NMP, pH levels changed more prominently, along with a reduction in pepsin. NOx content in MP with HH type II significantly exceeded control values, indicating active inflammatory processes. Conclusions. The results obtained confirm that among participants with physiological cardia insufficiency in HH, the composition of refluxate, the mechanisms and clinical features of reflux disease were different depending on the HH type and the professional status of the patient. Alkaline refluxate, high nitric oxide and total calcium concentrations are the dominant features of HH type II, especially in MP, whereas acidic refluxate was more commonly observed in MP with physiological cardia insufficiency in HH type I. This highlights the necessity of an individualized approach to the diagnosis and treatment of patients based on refluxate composition.
неспроможність фізіологічної кардії; грижа стравохідного отвору діафрагми; слина; шлунковий сік; біохімічні показники
physiological cardia insufficiency; hiatal hernia; saliva; gastric juice; biochemical markers
Вступ
Матеріали та методи
Результати
/11.jpg)
Обговорення
Висновки
- Babîi OM, Prolom NV, Shevchenko BF, Halinska AM, Poliak NV, Pakholka OV. Diagnosis and correction of complications of insufficiency of anti-reflux function of the physiological cardia in hiatal hernias. World Biol Med. 2022 Jan;24(1):30-38. doi: 10.26724/2079-8334-2022-4-82-20-25.
- Liu T, Liu J, Ma S, Wang X, Guo X, Qi X. Association of Gastrointestinal Symptoms with Depression and Anxiety in Recruits: A Validation Cross-Sectional Study. Adv Ther. 2024 Aug;41(8):3173-3182. doi: 10.1007/s12325-024-02911-z.
- Greene-Cramer B, Summers A, Lopes-Cardozo B, Husain F, Couture A, Bilukha O. Noncommunicable disease burden among conflict-affected adults in Ukraine: A cross-sectional study of prevalence, risk factors, and effect of conflict on severity of disease and access to care. PLoS One. 2020 Apr 21;15(4):e0231899. doi: 10.1371/journal.pone.0231899.
- Heda R, Toro F, Tombazzi CR. Physiology, Pepsin. 2023 May 1. In: StatPearls [Internet]. StatPearls Publishing.
- Samuels TL, Johnston N. Pepsin in gastroesophageal and extraesophageal reflux: molecular pathophysiology and diagnostic utility. Curr Opin Otolaryngol Head Neck Surg. 2020 Dec;28(6):401-409. doi: 10.1097/MOO.0000000000000664.
- Argüero J, Sifrim D. Pathophysiology of gastro-oesophageal reflux disease: implications for diagnosis and management. Nat Rev Gastroenterol Hepatol. 2024 Apr;21(4):282-293. doi: 10.1038/s41575-023-00883-z.
- Guo Z, Wu H, Jiang J, Zhang C. Pepsin in Saliva as a Diagnostic Marker for Gastroesophageal Reflux Disease: A Meta-Analysis. Med Sci Monit. 2018 Dec 31;24:9509-9516. doi: 10.12659/MSM.913978.
- Zhang M, Chia C, Stanley C, Phyland DJ, Paddle PM. Diagnostic Utility of Salivary Pepsin as Compared With 24-Hour Dual pH/Impedance Probe in Laryngopharyngeal Reflux. Otolaryngol Head Neck Surg. 2021 Feb;164(2):375-380. doi: 10.1177/0194599820951183.
- Du X, Wang F, Hu Z, Wu J, Wang Z, Yan C, Zhang C, Tang J. The diagnostic value of pepsin detection in saliva for gastro-esophageal reflux disease: a preliminary study from China. BMC Gastroenterol. 2017 Oct 17;17(1):107. doi: 10.1186/s12876-017-0667-9.
- Sole ML, Conrad J, Bennett M, Middleton A, Hay K, Ashworth S, Mehta DI. Pepsin and amylase in oral and tracheal secretions: a pilot study. Am J Crit Care. 2014 Jul;23(4):334-8. doi: 10.4037/ajcc2014292.
- Gąsiorowska A. Protection and regeneration of esophageal, pharyngeal, and laryngeal mucosa as a major element in therapy of patients with esophageal and extraesophageal reflux symptoms. Otolaryn–gol Pol. 2020 Aug 21;74(4):40-45. doi: 10.5604/01.3001.0014.3614.
- Patel V, Ma S, Yadlapati R. Salivary biomarkers and esophageal disorders. Dis Esophagus. 2022 Jul 12;35(7):doac018. doi: 10.1093/dote/doac018.
- Sun D, Wang X, Gai Z, Song X, Jia X, Tian H. Bile acids but not acidic acids induce Barrett's esophagus. Int J Clin Exp Pathol. 2015 Feb 1;8(2):1384-92.
- Dosedělová V, Itterheimová P, Kubáň P. Analysis of bile acids in human biological samples by microcolumn separation techniques: A review. Electrophoresis. 2021 Jan;42(1-2):68-85. doi: 10.1002/elps.202000139.
- Gittings S, Turnbull N, Henry B, Roberts CJ, Gershkovich P. Characterisation of human saliva as a platform for oral dissolution medium development. Eur J Pharm Biopharm. 2015 Apr;91:16-24. doi: 10.1016/j.ejpb.2015.01.007.
- Zub RI, Bychkova SV, Bychkov MA. Indicators of gastric juice and saliva in anatomical-topographical and functional disorders of physiological cardia. Fiziol Zh. 2017 Nov;63(6):99-105. doi: https://doi.org/10.15407/fz63.06.099.
- Wang YJ, Lang XQ, Wu D, He YQ, Lan CH, Xiao X et al. Salivary Pepsin as an Intrinsic Marker for Diagnosis of Sub-types of Gastroesophageal Reflux Disease and Gastroesophageal Reflux Disease-related Disorders. J Neurogastroenterol Motil. 2020 Jan 30;26(1):74-84. doi: 10.5056/jnm19032.
- Yadlapati R, Kaizer A, Greytak M, Ezekewe E, Simon V, Wani S. Diagnostic performance of salivary pepsin for gastroesopha–geal reflux disease. Dis Esophagus. 2021 Apr 7;34(4):doaa117. doi: 10.1093/dote/doaa117.
- Richter JE. Role of the gastric refluxate in gastroesophageal reflux disease: acid, weak acid and bile. Am J Med Sci. 2009 Aug;338(2):89-95. doi: 10.1097/MAJ.0b013e3181ad584a.
- Stasyshyn AR, Bychkov MA, Bychkova SV. A new method of diagnosis of the hiatal hernia associated with gastroesophageal reflux disease. Wiad Lek. 2019;72(2):186-188.

/9.jpg)
/10.jpg)