Журнал "Гастроэнтерология" Том 59, №1, 2025
Вернуться к номеру
Пепсиноген І як маркер ризику деструкції слизової оболонки шлунка в Helicobacter pylori-інфікованих пацієнтів, які приймають ацетилсаліцилову кислоту
Авторы: Палій І.Г., Заїка С.В., Капітун А.Г., Музичук О.М.
Вінницький національний медичний університет ім. М.І. Пирогова, м. Вінниця, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
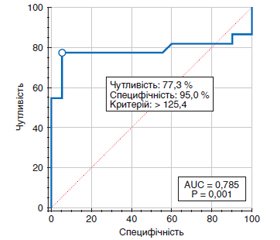
Актуальність. Антиагрегантна терапія є основним компонентом лікування пацієнтів з високим ризиком розвитку серцево-судинних ускладнень. Антиагреганти, які використовують для запобігання тромбоутворенню, можуть мати низку негативних впливів на шлунково-кишковий тракт, таких як кровотечі та виразки. Додатковим чинником, що може призвести до утворення виразок, які можуть бути причиною кровотечі, є інфекція Helicobacter pylori (Нр). Мета: оцінити вплив ацетилсаліцилової кислоти (АСК) у дозі 75 мг на рівень пепсиногену І у хворих з патологією серцево-судинної системи залежно від Нр-статусу і прийому пантопразолу. Матеріали та методи. Проведено визначення рівня пепсиногену І у 82 хворих, які приймали АСК у дозі 75 мг не менше ніж 1 рік з приводу захворювань серцево-судинної системи і не отримували антигелікобактерної фармакотерапії в анамнезі, серед яких 40 хворих на момент звернення приймали як гастропротектор інгібітор протонної помпи пантопразол у дозі 40 мг на добу тривалістю не менше ніж 1 місяць. Результати. У Нр-позитивних пацієнтів, які не приймали пантопразол, рівень пепсиногену І становив (122,2 ± 10,4) мкг/л, у групі Нр-негативних пацієнтів, які не приймали пантопразол, рівень пепсиногену І становив (89,7 ± 5,4) мкг/л. У групі Нр-позитивних осіб, які приймали пантопразол, і групі Нр-негативних хворих, які приймали пантопразол, рівні пепсиногену І становили (96,1 ± 6,8) мкг/л і (86,6 ± 5,4) мкг/л відповідно. Порівняльний аналіз виявив, що в пацієнтів, які приймали тільки АСК у дозі 75 мг і були Нр-негативними, рівень пепсиногену був вірогідно меншим (p < 0,003), ніж у пацієнтів, які приймали тільки АСК у дозі 75 мг і були Нр-позитивними. За результатами аналізу ROC-кривої встановлено, що найкраща точка відсічення для рівня пепсиногену І, при якому з’являється ризик пошкодження слизової оболонки шлунка, становить > 125,4 мкг/л (чутливість 77,3 % (95% ДІ: 54,6–92,2), специфічність 95,0 % (95% ДІ: 75,1–99,9); AUC 0,785 ± 0,080; р < 0,001). Нами встановлено вірогідний обернений кореляційний зв’язок (p < 0,01) між рівнем пепсиногену І та інфікованістю Нр. Коефіцієнт кореляції становив –0,53, що свідчить про помірний зв’язок досліджених параметрів. Не було встановлено вірогідних відмінностей (p > 0,05) за рівнем пепсиногену І між Нр-негативними та Нр-позитивними пацієнтами, які приймали АСК у дозі 75 мг і пантопразол у дозі 40 мг. При порівнянні Нр-позитивних пацієнтів, які отримували тільки АСК, і пацієнтів, які отримували АСК і пантопразол, було встановлено вірогідне зменшення (p < 0,04) рівня пепсиногену І. Рівні пепсиногену І у таких групах становили (122,2 ± 10,4) мкг/л проти (96,1 ± 6,8) мкг/л відповідно. Не встановлено вірогідних відмінностей (p > 0,05) за рівнем пепсиногену І між Нр-негативними групами хворих: особами, які приймали тільки АСК, і хворими, які приймали АСК і пантопразол. Рівні пепсиногену І у таких групах становили (89,7 ± 5,4) мкг/л проти (86,6 ± 5,4) мкг/л відповідно. Висновки. Наявність Нр-інфекції у хворих, які отримують АСК навіть у малих дозах (75 мг), є фактором ризику вірогідного підвищення (p < 0,003) рівня пепсиногену І. Прийом пантопразолу вірогідно зменшує (p < 0,04) рівень пепсиногену І (маркер деструкції слизової оболонки шлунка) у Нр-інфікованих пацієнтів, які отримують АСК у малих дозах (75 мг). Отже, пантопразол може вважатись препаратом вибору у вказаної категорії хворих.
Background. Antiplatelet therapy is a major component of the treatment in patients at high risk of cardiovascular complications. Antiplatelet agents that are used to prevent blood clots can have several adverse effects on the gastrointestinal tract, such as bleeding and ulcers. An additional factor that can lead to the formation of ulcers, which can cause bleeding, is the Helicobacter pylori (Hp) infection. The purpose was to assess the effect of acetylsalicylic acid (ASA) at a dose of 75 mg on the level of pepsinogen I in patients with сardiovascular disease depending on the Hp status and pantoprazole intake. Materials and methods. The level of pepsinogen I was determined in 82 patients who had been taking ASA at a dose of 75 mg over at least 1 year for сardiovascular disease and had not a history of anti-helicobacter pharmacotherapy, among which 40 individuals had been received pantoprazole, a proton pump inhibitor, at a dose of 40 mg/day for at least 1 month as a gastroprotector at the time of referral. Results. In Hp-positive patients who did not take pantoprazole, the level of pepsinogen I was (122.2 ± 10.4) μg/l, in the group of Hp-negative patients who did not receive pantoprazole, the level of pepsinogen I was (89.7 ± 5.4) μg/l. In Hp-positive and Hp-negative individuals who took pantoprazole, the levels of pepsinogen I were (96.1 ± 6.8) μg/l and (86.6 ± 5.4) μg/l, respectively. A comparative analysis showed that in patients who took only ASA at a dose of 75 mg and were Hp-negative, the level of pepsinogen was significantly lower (p < 0.003) than in those who also took only ASA at a dose of 75 mg and were Hp-positive. According to the results of ROC curve analysis, the best cutoff point for the level of pepsinogen I, at which the risk of damage to the gastric mucosa appears, is > 125.4 μg/l (sensitivity 77.3 % (95% CI: 54.6–92.2), specificity 95.0 % (95% CI: 75.1–99.9), AUC 0.785 ± 0.080; p < 0.001). We found a significant inverse correlation (p < 0.01) between the level of pepsinogen I and the incidence of Hp infection. The correlation coefficient was –0.53 indicating a moderate relationship between the studied parameters. No significant differences (p > 0.05) were found in the level of pepsinogen I between Hp-negative and Hp-positive patients who took ASA at a dose of 75 mg and pantoprazole at a dose of 40 mg. When comparing Hp-positive groups who received only ASA and patients who took ASA and pantoprazole, a significant decrease (p < 0.04) in the level of pepsinogen I was found. The levels of pepsinogen I in such groups were (122.2 ± 10.4) μg/l versus (96.1 ± 6.8) μg/l, respectively. No significant differences (p > 0.05) were found in the level of pepsinogen I between the Hp-negative groups of patients: individuals who took only ASA and those who took ASA and pantoprazole. Pepsinogen I levels in these groups were (89.7 ± 5.4) μg/L versus (86.6 ± 5.4) μg/L, respectively. Conclusions. The presence of Hp infection in patients receiving ASA even in low doses (75 mg) is a risk factor for a significant increase (p < 0.003) in the level of pepsinogen I. Taking pantoprazole significantly reduces (p < 0.04) the level of pepsinogen I (a marker of destruction of the gastric mucosa) in Hp-infected patients receiving ASA in low doses (75 mg). Thus, pantoprazole can be considered the drug of choice in this category of patients.
патологія серцево-судинної системи; ацетилсаліцилова кислота; антиагреганти; Helicobacter pylori; слизова оболонка; пепсиноген І; інгібітори протонної помпи; пантопразол
cardiovascular disease; acetylsalicylic acid; antiplatelet agents; Helicobacter pylori; gastric mucosa; pepsinogen I; proton pump inhibitors; pantoprazole
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- World Health Organization. Noncommunicable diseases country profiles 2018. Accessed September 6, 2019.
- Townsend N, Wilson L, Bhatnagar P, et al. Cardiovascular disease in Europe: epidemiological update 2016. Eur Heart J. 2016;37(42):3232-3245.
- GBD 2019 Risk Factors Collaborators. Global burden of 87 risk factors in 204 countries and territories, 1990–2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 2020.
- Chen S, Kuhn M, Prettner K, Bloom DE. The macroeconomic burden of noncommunicable diseases in the United States: Estimates and projections. PLoS ONE. 2018;13(11):e0206702. doi: 10.1371/journal.pone.0206702.
- Arnett DK, Blumenthal RS, Albert MA, et al. 2019 ACC/AHA guideline on the primary prevention of cardiovascular disease: A report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2019;140(11):e596-e646. doi: 10.1161/CIR.0000000000000678.
- Jousilahti P, Laatikainen T, Peltonen M, et al. Primary prevention and risk factor reduction in coronary heart disease mortality among working aged men and women in eastern Finland over 40 years: population-based observational study. BMJ. 2016;352:i721. doi: 10.1136/bmj.i721.
- Лутай М.І. Сучасні принципи медикаментозного лікування хворих зі стабільною стенокардією. Національна фармакотерапія. 2018;2(1):3-8.
- Нетяженко Н.В. Оцінка ефективності антитромбоцитарних препаратів у неврологічній та кардіологічній практиці: стан проблеми, гендерні відмінності, можливості оптимізації. Український неврологічний журнал. 2015;2:14-18.
- Visseren FLJ, Mach F, Smulders YM, et al. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice: Developed by the Task Force for cardiovascular disease prevention in clinical practice with representatives of the European Society of Cardiology and 12 medical societies. Eur Heart J. 2021;42(34):3227-3337. doi: 10.1093/eurheartj/ehab484.
- Łabuz-Roszak B, Horyniecki M, Łącka-Gaździk B. Acetylsalicylic acid in the prevention and treatment of cardiovascular diseases. 2018.
- Zuo HJ, Deng LQ, Wang JW. Current status and the consistency analysis of using two criteria for decision making of aspirin use for the primary prevention of ischemic cardiovascular disease in outpatients. Zhonghua Xin Xue Guan Bing Za Zhi. 2018;46(4):298-303. doi: 10.3760/cma.j.issn.0253-3758.2018.04.009.
- Almas A, Karim M, Murtaza G, et al. Aspirin in primary prevention of myocardial infarction/angina and stroke in hypertensive patients. J Coll Physicians Surg Pak. 2018;28(7):519-524. doi: 10.29271/jcpsp.2018.07.519.
- Løn N, Engel S, Damholt A, et al. Bifidobacterium breve Bif195 ameliorates aspirin-induced gastric mucosal damage: A randomised, double-blind, placebo-controlled crossover trial. Aliment Pharmacol Ther. 2024;59(3):341-349. doi: 10.1111/apt.17817.
- Arnett DK, Blumenthal RS, Albert MA, et al. 2019 ACC/AHA Guideline on the Primary Prevention of Cardiovascular Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol. 2019;74(10):e177-e232. doi: 10.1016/j.jacc.2019.03.010.
- Палій І.Г., Заїка С.В., Янковецька А.Г. Ураження шлунково-кишкового тракту у хворих із патологією серцево-судинної системи, які приймають ацетилсаліцилову кислоту: синдромальна діагностика та можливі шляхи корекції. Сучасна гастроентерологія. 2015;(3):29-38.
- Hawk ET, Maresso KC. The ASPREE Trial: An unanticipated stimulus for greater precision in prevention? J Natl Cancer Inst. 2021;113(3):221-222. doi: 10.1093/jnci/djaa169.
- McNeil JJ, Woods RL, Nelson MR, et al. Baseline characteri–stics of participants in the ASPREE (Aspirin in Reducing Events in the Elderly) study. J Gerontol A Biol Sci Med Sci. 2017;72(11):1586-1593. doi: 10.1093/gerona/glx151.
- Шапринський В.О., Романчук В.Д., Коваль В.М. Тактика і результати лікування гострої кровотечі за виразково-ерозивного ураження гастродуоденальної зони внаслідок застосування препаратів гастроагресивної дії. Клінічна хірургія. 2014;(9):10-13.
- Li Z, Fu S, Yang J, et al. Effects of aspirin on the gastrointestinal tract: Pros vs. cons. Oncol Lett. 2020;20(3):1-10. doi: 10.3892/ol.2020.11845.
- Cea Soriano L, Bueno H, Lanas A, García Rodríguez LA. Cardiovascular and upper gastrointestinal bleeding consequences of low-dose acetylsalicylic acid discontinuation. Thromb Haemost. 2013;110(6):1298-1304. doi: 10.1160/TH13-03-0215.
- Hamood H, Hamood R, Green MS, Almog R. Effect of adherence to evidence-based therapy after acute myocardial infarction on all-cause mortality. Pharmacoepidemiol Drug Saf. 2015;24(10):1093-1104. doi: 10.1002/pds.3810.
- Malfertheiner P, Megraud F, Rokkas T, et al. Management of Helicobacter pylori infection: the Maastricht VI/Florence consensus report. Gut. 2022;71(9):1724-1762. doi: 10.1136/gutjnl-2022-327745.
- Guo CG, Zhang HH, Singh A, et al. Divergent trends of hospitali–zations for upper and lower gastrointestinal bleeding based on population prescriptions of aspirin, proton pump inhibitors and Helicobacter pylori eradication therapy. United European Gastroenterol J. 2021;9(5):609-618.
- Guo CG, Zhang HH, Singh A, et al. Incidences, temporal trends and risks of hospitalisation for gastrointestinal bleeding in new or chronic low-dose aspirin users after treatment for Helicobacter pylori: a territory-wide cohort study. Gut. 2020;69(3):445-453.
- Syrjänen K, Leivonen M, Haapanen H, et al. GastroPanel® biomarker assay: the most comprehensive test for Helicobacter pylori infection and its clinical sequelae. A critical review. Anticancer Res. 2019;39(3):1091-1101.
- Gastrointestinal and Liver Disease (Ninth Edition). 2010;1:817-832.e7.
- Shah SC, Piazuelo MB, Kuipers EJ. AGA Clinical Practice Update on the Diagnosis and Management of Atrophic Gastritis: Expert Review. Gastroenterology. 2021;161(4):1325-1337.
- Samloff IM, Secrist DV, Passaro E. A study of the relationship between serum group I pepsinogen and acid secretion. Gastroenterology. 1975;69(6):1196-1200.
- Melashchenko S. Assessment of gastric acidity by short-duration intragastric pH-monitoring with standardised breakfast in functional and some other dyspepsias. Gastroenterology Rev. 2020;15(3):258-266. doi: 10.5114/pg.2020.99041.
- Зак М.Ю. Рівень сироваткового пепсиногену-1 в залежності від наявності та ступеня атрофії слизової оболонки тіла шлунка у пацієнтів із хронічним H. pylori-асоційованим гастритом. Науковий вісник Ужгородського університету, серія «Медицина». 2009;36:20-22.
- Huang RJ, Hwang JH. Improving the Early Diagnosis of Gastric Cancer. Gastrointest Endosc Clin N Am. 2021;31(3):503-517. doi: 10.1016/j.giec.2021.02.005.
- Koc DO. Serum pepsinogen levels and OLGA/OLGIM staging in the assessment of atrophic gastritis types. Postgrad Med J. 2022;98(1160):441-445.
- Miki K, Urita Y. Using serum pepsinogens wisely in a clinical practice. J Dig Dis. 2007;8(1):8-14. doi: 10.1111/j.1443-9573.2007.00278.x.
- Miwa H, Ohkusa T, Nomura T, Asaoka D, Kurosawa A, Sakamoto N, Abe S, Hojo M, Terai T, Ogihara T, Sato N. Improvement in serum pepsinogens and gastrin in long-term monitoring after eradication of Helicobacter pylori: comparison with H. pylori-negative patients. Aliment Pharmacol Ther. 2004;20(Suppl 1):25-32. doi: 10.1111/j.1365-2036.2004.01970.x.
- Lanas AI, Nerín J, Esteva F, Sáinz R. Non-steroidal anti-inflammatory drugs and prostaglandin effects on pepsinogen secretion by dispersed human peptic cells. Gut. 1995;36(5):657-663. doi: 10.1136/gut.36.5.657.
- Kono Y, Okada H, Takenaka R, Miura K, Kanzaki H, Hori K, et al. Does Helicobacter pylori exacerbate gastric mucosal injury in users of nonsteroidal anti-inflammatory drugs? A multicenter, retrospective, case-control study. Gut Liver. 2016;10(1):69-75. doi: 10.5009/gnl14372.
- Santucci L, Fiorucci S, Patoia L, Di Matteo FM, Brunori PM, Morelli A. Severe gastric mucosal damage induced by NSAIDs in healthy subjects is associated with Helicobacter pylori infection and high levels of serum pepsinogens. Dig Dis Sci. 1995;40(9):2074-2080. doi: 10.1007/BF02208681.
- Shan J, Lei H, Shi W, Sun X, Tang Y, Ren C. High serum pepsinogen I and beta Helicobacter pylori infection are risk factors for aspirin-induced gastroduodenal injury. Dig Dis. 2018;36(1):66-71. doi: 10.1159/000477203.
- Jha AK, Kumari A. Comparative study of esomeprazole and omeprazole on human by serum pepsinogen-I estimation method as a biomar–ker of gastric inflammation. Int J Health Clin Res. 2021;4(19):371-373.
- Di Mario F, Ingegnoli A, Altavilla N, Cavallaro LG, Bertolini S, Merli R, et al. Influence of antisecretory treatment with proton pump inhibitors on serum pepsinogen I levels. Fundam Clin Pharmacol. 2005;19(4):497-501. doi: 10.1111/j.1472-8206.2005.00348.x.
- Мелащенко С.Г., Чернобровий В.М., Байол Я.О., Кізлова Н.М. Динаміка сироваткових пепсиногенів на тлі прийому подвійних стандартних доз омепразолу у хворих на гастроезофагеальну рефлюксну хворобу та функціональні шлункові диспепсії. Гастроентерологія. 2013;3(49):32-39.
- Abuduwaili М, Boda Т, Ito М, Takigawa Н, Kotachi Т, Matsuo Т, Oka S, Tanaka S. Serum Gastrin and Pepsinogen Levels after Administration of Acid Secretion Inhibitors for Ulcers due to Endoscopic Submucosal Dissection in Patients with Early Gastric Cancer. Gastroenterology Research and Practice. 2022;2022;2830227. doi: 10.1155/2022/2830227.
- Bardhan KD, Cherian P, Bishop AE, Polak JM, Romanska H, Perry MJ, et al. Pantoprazole therapy in the long-term management of severe acid peptic disease: clinical efficacy, safety, serum gastrin, gastric histology, and endocrine cell studies. Am J Gastroenterol. 2001 Jun;96(6):1767-76. doi: 10.1111/j.1572-0241.2001.03185.x.
- Chan FK, Chung SC, Suen BY, Lee YT, Leung WK, Leung VK, et al. Preventing recurrent upper gastrointestinal bleeding in patients with Helicobacter pylori infection who are taking low-dose aspirin or naproxen. N Engl J Med. 2001 Mar 29;344(13):967-73. doi: 10.1056/NEJM200103293441304.
- Zhural’ova LV, Oliynyk MO. NSAID-induced gastropathy in family medicine practice. Suchasna Gastroenterology. 2018;3(101):48-53.
- Battaglia G, Germanà B, Marin R, Valerio G. Pantoprazole versus one-week Helicobacter pylori eradication therapy for the prevention of acute NSAID-related gastroduodenal damage in elderly subjects. Aliment Pharmacol Ther. 2000 Aug;14(8):1077-82. doi: 10.1046/j.1365-2036.2000.00804.x. PMID: 10930903.

/27.jpg)