Журнал "Гастроэнтерология" Том 59, №1, 2025
Вернуться к номеру
Оптимізація лікування гастроезофагеальної рефлюксної хвороби в осіб молодого віку: роль та місце ребаміпіду
Авторы: Скрипник І.М., Городницька І.М., Маслова Г.С., Филенко Б.М.
Полтавський державний медичний університет, м. Полтава, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
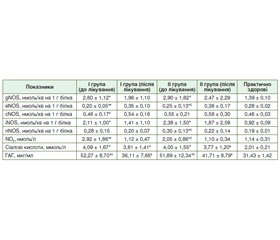
Актуальність. Гастроезофагеальна рефлюксна хвороба (ГЕРХ) — це стан, що є наслідком закидання кислого вмісту шлунка до стравоходу і викликає появу печії чи регургітації. Одним із ключових факторів патогенезу цього захворювання є порушення захисної функції фізіологічних антирефлюксних бар’єрів слизової оболонки стравоходу. Мета: оцінити вплив ребаміпіду на відновлення захисного бар’єра стравоходу за наявності ерозивної або неерозивної форми ГЕРХ у пацієнтів молодого віку. Матеріали та методи. Обстежено 30 хворих на ГЕРХ молодого віку від 18 до 45 років, які страждають на ГЕРХ. Згідно з результатами верхньої ендоскопії сформовано дві групи: І група — 15 пацієнтів з ерозивною формою ГЕРХ та ІІ група — 15 пацієнтів з неерозивною ГЕРХ, що не асоційовані з H. pylori. Контрольну групу становили 15 практично здорових осіб. Обидві групи хворих приймали інгібітори протонної помпи (ІПП; пантопразол) у стандартних дозах та ребаміпід протягом 30 днів. Учасникам дослідження до та після лікування визначали показники системи NO у плазмі крові: активність сумарної синтази оксиду азоту (gNOS), індуцибельної форми NOS (iNOS), нейрональної (nNOS) та ендотеліальної (еNOS) форми NOS; функціональну активність поверхнево-епітеліальних клітин слизової оболонки стравоходу оцінювали за рівнем сіалових кислот та глікозаміногліканів. Результати. Ознаки ендотеліальної дисфункції при ГЕРХ проявлялися значним підвищенням рівня iNOS у 2,3 раза при ерозивній ГЕРХ (p = 0,0048) і у 2,6 раза — при неерозивній ГЕРХ (p = 0,007) порівняно з контрольною групою. Активність eNOS була в 1,2 раза нижчою, ніж у контрольній групі, як у пацієнтів з ерозивною (p = 0,0005), так і з неерозивною ГЕРХ (р = 0,0007). nNOS зросла в 1,6 раза (р = 0,04) у пацієнтів з неерозивною ГЕРХ, але її рівень значно знизився після лікування (р = 0,04). Рівень нітритів (NO2) був у 2,6 раза вищим у пацієнтів з ерозивною ГЕРХ (p < 0,0001) та у 1,8 раза вищим при неерозивній ГЕРХ (р = 0,0022) порівняно з групою практично здорових осіб. Нормалізація рівнів сіалової кислоти і глікозаміногліканів після лікування комплексом ІПП + ребаміпід (p < 0,0001 і p = 0,0001 відповідно) є підтвердженням відновних та захисних функцій слизової оболонки стравоходу як при ерозивній, так і при неерозивній формі ГЕРХ у молодих пацієнтів. Висновки. Додавання ребаміпіду до монотерапії ІПП мало значні переваги щодо корекції показників ендотеліальної дисфункції у хворих як на ерозивну, так і на неерозивну форму ГЕРХ, сприяючи зниженню запальної інфільтрації епітеліального шару і підслизової основи слизової оболонки стравоходу, відновленню епітелію, загоєнню ерозій, що відіграє важливу роль у протективних та репаративних процесах слизової стравоходу. Хоча дослідження, присвячені впливу ребаміпіду на бар’єр слизової оболонки стравоходу, обмежені, механізми його дії свідчать про потенційну користь. Отримані дані можуть бути орієнтирами для подальших клінічних досліджень щодо ефективності ребаміпіду у лікуванні ГЕРХ.
Background. Gastroesophageal reflux disease (GERD) is a condition that results from the reflux of acidic stomach contents into the esophagus and causes heartburn or regurgitation. One of the key factors in the pathogenesis of this disease is the disruption of the protective function of the physiological antireflux barriers of the esophageal mucosa. Objective: to evaluate the effect of rebamipide on the restoration of the esophageal protective barrier in the presence of erosive or non-erosive forms of gastroesophageal reflux disease in young patients. Materials and methods. Thirty young patients with GERD aged 18 to 45 years were examined. According to the results of upper endoscopy, two groups were formed: group I — 15 individuals with erosive GERD and group II — 15 people with non-erosive GERD, not associated with H.pylori. The control group consisted of 15 practically healthy individuals. Both groups of patients took proton pump inhibitors (PPIs) (pantoprazole) in standard doses and rebamipide for 30 days. The participants were examined for indicators of the NO system in the blood plasma before and after treatment: the general activity of total nitric oxide synthase (gNOS), inducible (iNOS), neuronal (nNOS) and endothelial (eNOS) forms of NOS; the functional activity of surface epithelial cells of the esophageal mucosa was assessed by the level of sialic acids and glycosaminoglycans. Results. Signs of endothelial dysfunction in GERD were manifested by a significant increase in the level of iNOS by 2.3 times in erosive GERD (p = 0.0048) and by 2.6 times in non-erosive GERD (p = 0.007) compared to the control group. eNOS activity was 1.2-fold lower than in the control group in both erosive (p = 0.0005) and non-erosive GERD (p = 0.0007). nNOS increased 1.6-fold (p = 0.04) in non-erosive GERD, but its level decreased significantly after treatment (p = 0.04). Nitrite (NO₂) levels were 2.6-fold higher in erosive GERD (p < 0.0001) and 1.8-fold higher in non-erosive GERD (p = 0.0022) compared to the control group. The normalization of sialic acid and glycosaminoglycan levels after treatment with the PPI + rebamipide complex (p < 0.0001 and p = 0.0001, respectively) is a confirmation of the restorative and protective functions of the esophageal mucosa in both erosive and non-erosive GERD in young patients. Conclusions. The addition of rebamipide to the PPI monotherapy had significant advantages in terms of correcting endothelial dysfunction indicators in patients with both erosive and non-erosive forms of GERD, contributing to the reduction of inflammatory infiltration of the epithelial layer and submucosal base of the esophageal mucosa, restoration of the epithelium, and healing of erosions, which has an important role in the protective and reparative processes of the esophageal mucosa. Although studies regarding the effect of rebamipide on the esophageal mucosal barrier are limited, the mechanisms of its action indicate a potential benefit. The data obtained may be guidelines for further clinical studies on the effectiveness of rebamipide in the treatment of gastroesophageal reflux disease.
гастроезофагеальна рефлюксна хвороба; молодий вік; цитопротекція; резистентність слизової оболонки; ребаміпід
gastroesophageal reflux disease; young age; cytoprotection; mucosal resistance, rebamipide
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Peery A, Crockett S, Murphy C, Jensen E, Kim H, Egberg M, et al. Burden and cost of gastrointestinal, liver and pancreatic diseases in the United States: Update 2021. Gastroenterology. 2022;162(2):621-644. https://doi.org/10.1053/j.gastro.2021.10.017.
- Gardner JD. The relationship between esophageal acidity and symptom frequency in symptomatic nonerosive gastroesophageal reflux disease. Physiol Rep. 2022 Aug;10(16):e15442. doi: 10.14814/phy2.15442. PMID: 36029198; PMCID: PMC9419155.
- Ma S, Patel V, Yadlapati R. Factors that Impact Day-to-Day Esophageal Acid Reflux Variability and Its Diagnostic Significance for Gastroesophageal Reflux Disease. Dig Dis Sci. 2022 Jul;67(7):2730-2738. doi: 10.1007/s10620-022-07496-7. Epub 2022 Apr 19. PMID: 35441274; PMCID: PMC9377569.
- Pellegatta G, Mangiavillano B, Semeraro R, Auriemma F, Carlani E, Fugazza A, et al. The Effect of Hyaluronic Acid and Chondroitin Sulphate-Based Medical Device Combined with Acid Suppression in the Treatment of Atypical Symptoms in Gastroesophageal Reflux Disease. J Clin Med. 2022 Mar 29;11(7):1890. doi: 10.3390/jcm11071890. PMID: 35407497; PMCID: PMC9000081.
- Kashyrtseva O, Novokhatnia A, Khomenko L, Oparin O, Oparina T. Endotelialna dysfunktsiia ta hastroesofahealna refluksna khvoroba: doslidzhennia spilnykh patohenetychnykh mekhanizmiv ta shliakhiv korektsii. Klinichna ta profilaktychna medytsyna. 2024;2(32):75-82 (Ukrainian). https://doi.org/10.31612/2616-4868.2.2024.10.
- Nejat Pish-Kenari F, Qujeq D, Maghsoudi H. Some of the effective factors in the pathogenesis of gastro-oesophageal reflux di–sease. J Cell Mol Med. 2018 Dec;22(12):6401-6404. doi: 10.1111/jcmm.13939.
- Gyawali C, Sonu I, Becker L, Sarosiek J. The esophageal mucosal barrier in health and disease: mucosal pathophysiology and protective mechanisms. Annals of the New York Academy of Sciences. 2020 Dec;1482(1):49-60. doi: 10.1111/nyas.14521.
- Shcherbуnina MB, Solovіovа NE. A strategy to protect the integrity of the esophageal mucosa in the treatment of gastroesophageal reflux disease. Modern Gastroenterology. 2020;1:46-52 (Ukrainian). http://doi.org/10.30978/MG-2020-1-46.
- Skrypnyk IM. Cytoprotective therapy in the modern gastroente–rology: the role and place of the rebamipide. Modern Gastroenterology. 2020;1:55-61 (Ukrainian). http://doi.org/10.30978/ MG-2020-1-55.
- Akimov OY, Kostenko VO. Functioning of nitric oxide cycle in gastric mucosa of rats under excessive combined intake of sodium nitrate and fluoride. Ukr Biochem J. 2016;88(6):70-5 (Ukrainian). https://doi.org/10.15407/ubj88.06.070.
- Kaidashev IP, redaktor. Metody klinichnykh ta eksperymental’nykh doslidzhen’ v medytsyni [Methods of clinical and experimental research in medicine]. Poltava; 2003. 320 s. (Ukrainian).
- Akbaş E, Gözde Ü. Can Tissue Nitric Oxide Synthesis 2 (iNOS) Levels Play a Role in the Pathophysiology of Reflux Esophagitis? Medical Science and Discovery. 2021;8(7):423-27. https://doi.org/–10.36472/msd.v8i7.576.
- Liang T, Deng R, Li X, Xu X, Chen G. The role of nitric oxide in peptic ulcer: a narrative review. Med Gas Res. 2021 Jan-Mar;11(1):42-45. doi: 10.4103/2045-9912.310059.
- Alves Júnior, Edvaldo B, et al. Estragole Prevents Gastric Ulcers via Cytoprotective, Antioxidant and Immunoregulatory Mechanisms in Animal Models. Biomedicine & Pharmacotherapy. 2020;130:110578. https://doi.org/10.1016/j.biopha.2020.110578.
- Xiang X, Palasuberniam P, Pare R. The Role of Estrogen across Multiple Disease Mechanisms. Current Issues in Molecular Biology. 2024;46(8):8170-8196. doi: 10.3390/cimb46080483.
- Idrizaj E, Traini C, Vannucchi MG, Baccari MC. Nitric oxi–de: from gastric motility to gastric dysmotility. Intern. J. Molecular Sciences. 2021;22(18):9990. https://doi.org/10.3390/ijms22189990.
- Pochinok T, Zhuravel O, Chernov O. Content of nitrogen oxide and its metabolites in blood and esophageal mucosa in children sickly with respiratory diseases against the background of gastroesophageal reflux disease. Sovremennaya pediatriya. 2019;2(98):31-34 (Ukrainian). https://doi.org/10.15574/sp.2019.98.31.
- Sokolovskaya OM, et al. Sialic acid diversity in the human gut: molecular impacts and tools for future discovery. Current Opinion in Structural Biology. 2022;75:102397. https://doi.org/10.1016/j.sbi.2022.102397.
- Traserra S, Cuerda H, Vallejo A, Segarra S, Sabata R, Jime–nez M. Gastroprotective effects of oral glycosaminoglycans with sodium alginate in an indomethacin-induced gastric injury model in rats. Veterinary Sciences. 2023;10(12):667. https://doi.org/10.3390/ vetsci10120667.
- Skrypnyk IM. Biochemical mechanisms of gastric ulcer development under stress conditions. Ukrainian Biochemical Journal. 2001;1:110-114.