Журнал "Гастроэнтерология" Том 59, №1, 2025
Вернуться к номеру
Вплив стеатозу печінки на тяжкість перебігу COVID-19 у хворих на хронічний коронарний синдром
Авторы: Жайворонок М.М. (1, 2), Мостовий С.Є. (2, 3), Сафонова О.М. (4)
(1) - Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
(2) - Медичний центр «Медбуд», м. Київ, Україна
(3) - Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
(4) - Київська міська клінічна лікарня № 18, м. Київ, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
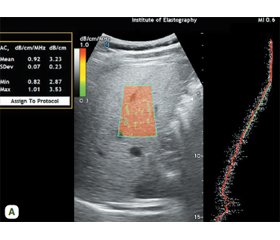
Актуальність. Коронавірусна хвороба 2019 року (COVID-19) лишається на сьогодні однією з найактуальніших глобальних проблем охорони здоров’я. Згідно із сучасними літературними даними COVID-19 може спровокувати погіршення функції печінки у пацієнтів з/без хронічних захворювань печінки. Відомо, що при COVID-19 відбувається реактивація вже наявних захворювань печінки, зокрема метаболічно асоційованої стеатотичної хвороби печінки (МАСХП) — до її подальшого прогресування з виходом у цироз. Найбільш уразливою групою хворих щодо коронавірусної хвороби та її ускладнень (включно з МАСХП) є пацієнти із хронічним коронарним синдромом (ХКС), тому прогностична ультразвукова оцінка стеатозу печінки (СП) відносно тяжкості перебігу й ускладнень COVID-19 є важливою. Метою нашого дослідження було оцінити вплив МАСХП на тяжкість перебігу COVID-19 у пацієнтів із ХКС. Матеріали та методи. Ми оцінювали томограми мультидетекторної комп’ютерної томографії (МДКТ) печінки 120 хворих, направлених на обстеження легень (41 жінка, середній вік 63,73 року), у яких було підтверджено COVID-19 і ХКС. Вимірювали значення ослаблення МДКТ печінки та селезінки, а також розраховували печінково-селезінковий коефіцієнт (ПСК) для виявлення МАСХП. Для виявлення незалежних ранніх предикторів тяжкого перебігу COVID-19 у хворих на ХКС використовували одновимірний і багатовимірний логістичний регресійний аналіз. Результати. Щільність печінки та ПСК при МАСХП були значно нижчими у пацієнтів, які перебували у відділенні інтенсивної терапії (ВІТ). Поширеність тяжкого перебігу захворювання була вищою у пацієнтів з хронічною ХКС у поєднанні з МАСХП, ніж у групі без МАСХП (відношення шансів (ВШ) 3,512, 95% довірчий інтервал (ДІ) 1,685–6,140, Р < 0,05). Після поправки на вік і супутні хвороби, як-от цукровий діабет, хронічні обструктивні захворювання легень і хронічні захворювання нирок, багатовимірний логістичний регресійний аналіз показав, що МАСХП є незалежним фактором ризику тяжкості COVID-19 (ВШ 3,675, 95% ДІ 1,495–7,263, P = 0,020) у хворих на ХКС. Висновки. МДКТ-оцінка печінки під час проведення дослідження органів грудної клітки, яка відіграє основну роль у діагностиці COVID-19, може надати інформацію про прогноз захворювання. МАСХП є важливою ознакою несприятливого прогнозу у хворих на ХКС і може бути виявлена при МДКТ за допомогою оцінки ПСК.
Background. The coronavirus disease 2019 (COVID-19) remains one of the most pressing global health issues today. According to contemporary literature, COVID-19 may trigger a deterioration of liver function in patients with or without pre-existing liver diseases. It is known that COVID-19 can lead to the reactivation of pre-existing liver conditions, such as metabolic dysfunction-associated steatotic liver disease (MASLD), causing its further progression to liver cirrhosis. Patients with chronic coronary syndrome (CCS) are most vulnerable to coronavirus disease and its complications (including MASLD). Therefore, prognostic ultrasound assessment of liver steatosis in terms of COVID-19 severity and complications is crucial. The aim of our study was to evaluate the impact of MASLD on the severity of COVID-19 in patients with chronic coronary syndrome. Materials and methods. In this study, we evaluated multidetector computed tomography (MDCT) scans of the liver from 120 patients (41 women, average age 63.73 years) who were referred for lung examination and had confirmed COVID-19 and CCS. We measured the attenuation values of the MDCT signal for the liver and spleen and calculated the liver-to-spleen ratio (LSR) to detect MASLD. Univariate and multivariate logistic regression analyses were used to identify independent early predictors of severe COVID-19 in patients with CCS. Results. Liver density and LSR in MASLD were significantly lower in patients who stayed in the intensive care unit. The prevalence of severe disease was higher in patients with CCS combined with MASLD than in the group without MASLD (odds ratio (OR) 3.512, 95% confidence interval (CI) 1.685–6.140, P < 0.05). After adjusting for age and comorbidities, including diabetes, chronic obstructive pulmonary disease, and chronic kidney disease, multivariate logistic regression analysis indicated that MASLD is an independent risk factor for the severity of COVID-19 (OR 3.675, 95% CI 1.495–7.263, P = 0.020) in patients with CCS. Conclusions. MDCT of the liver during chest organ imaging plays a crucial role in the diagnosis of COVID-19 and can provide information regarding the disease prognosis. MASLD is an important marker of poor prognosis in patients with CCS and can be detected on MDCT through LSR assessment.
мультидетекторна комп’ютерна томографія; COVID-19; метаболічно асоційована стеатотична хвороба печінки; хронічний коронарний синдром
multidetector computed tomography; COVID-19; metabolic dysfunction-associated steatotic liver disease; chronic coronary syndrome
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Ye Z, Zhang Y, Wang Y, Huang Z, Song B. Chest CT mani–festations of new coronavirus disease 2019 (COVID-19): a pictorial review. Eur Radiol. 2020 Aug;30(8):4381-4389. doi: 10.1007/s00330-020-06801-0.
- Bao C, Liu X, Zhang H, Li Y, Liu J. Coronavirus Disease 2019 (COVID-19) CT Findings: A Systematic Review and Meta-ana–lysis. J Am Coll Radiol. 2020 Jun;17(6):701-709. doi: 10.1016/j.jacr.2020.03.006.
- Yang W, Sirajuddin A, Zhang X, Liu G, Teng Z, Zhao S, Lu M. The role of imaging in 2019 novel coronavirus pneumonia (COVID-19). Eur Radiol. 2020 Sep;30(9):4874-4882. doi: 10.1007/s00330-020-06827-4.
- World Health Organization. Situation reports. Available from: https:// www.who.int/emergencies/diseases/novel‐coronavirus‐2019/ situation‐reports/ [Last accessed on 2020 Feb 22].
- Singhal T. A Review of Coronavirus Disease-2019 (COVID-19). Indian J Pediatr. 2020 Apr;87(4):281-286. doi: 10.1007/s12098-020-03263-6.
- Ai T, Yang Z, Hou H, Zhan C, Chen C, Lv W, Tao Q, Sun Z, Xia L. Correlation of Chest CT and RT-PCR Testing for Coronavirus Disease 2019 (COVID-19) in China: A Report of 1014 Cases. Radio–logy. 2020 Aug;296(2):E32-E40. doi: 10.1148/radiol.2020200642.
- Caruso D, Zerunian M, Polici M, Pucciarelli F, Polidori T, Rucci C, Guido G, Bracci B, De Dominicis C, Laghi A. Chest CT Features of COVID-19 in Rome, Italy. Radiology. 2020 Aug;296(2):E79-E85. doi: 10.1148/radiol.2020201237.
- Salehi S, Abedi A, Balakrishnan S, Gholamrezanezhad A. Coronavirus Disease 2019 (COVID-19): A Systematic Review of Imaging Findings in 919 Patients. AJR Am J Roentgenol. 2020 Jul;215(1):87-93. doi: 10.2214/AJR.20.23034.
- Ji D, Qin E, Xu J, Zhang D, Cheng G, Wang Y, Lau G. Non-alcoholic fatty liver diseases in patients with COVID-19: A retrospective study. J Hepatol. 2020 Aug;73(2):451-453. doi: 10.1016/j.jhep.2020.03.044.
- Xu L, Liu J, Lu M, Yang D, Zheng X. Liver injury during highly pathogenic human coronavirus infections. Liver Int. 2020 May;40(5):998-1004. doi: 10.1111/liv.14435.
- Cai Q, Huang D, Ou P, Yu H, Zhu Z, Xia Z, Su Y, Ma Z, Zhang Y, Li Z, He Q, Liu L, Fu Y, Chen J. COVID-19 in a designated infectious diseases hospital outside Hubei Province, China. Allergy. 2020 Jul;75(7):1742-1752. doi: 10.1111/all.14309.
- Li J, Fan JG. Characteristics and Mechanism of Liver Injury in 2019 Coronavirus Disease. J Clin Transl Hepatol. 2020 Mar 28;8(1):13-17. doi: 10.14218/JCTH.2020.00019.
- Garrido I, Liberal R, Macedo G. Review article: COVID-19 and liver disease-what we know on 1st May 2020. Aliment Pharmacol Ther. 2020 Jul;52(2):267-275. doi: 10.1111/apt.15813.
- Динник О.Б., Марунчин Н.А., Ковалеренко Л.С., Закревська С.О., Орієвська І.І., Жайворонок М.М. Роль одночасної ультразвукової еластометрії та стеатометрії при хронічних дифузних захворюваннях печінки інфекційної та неінфекційної етіології. Актуальна інфектологія. 2019. Т. 7. № 2. С. 46-47.
- Kobyliak N, Dynnyk O, Savytska M, Solodovnyk O, Zakomornyi O, Оmеlchenko O, Kushnir A, Titorenko R. Accuracy of atte–nuation coefficient measurement (ACM) for real-time ultrasound hepatic steatometry: Comparison of simulator/phantom data with magnetic resonance imaging proton density fat fraction (MRI-PDFF). Heliyon. 2023 Oct 4;9(10):e20642. doi: 10.1016/j.heliyon.2023.e20642. PMID: 37818006; PMCID: PMC10560839.
- Saba L, di Martino M, Bosco S, Del Monte M, de Cecco CN, Lombardo V, Piga M, Catalano C. MDCT classification of steato–tic liver: a multicentric analysis. Eur J Gastroenterol Hepatol. 2015 Mar;27(3):290-7. doi: 10.1097/MEG.0000000000000277.
- Zhaivoronok ММ, Fedusenko ОА. Correlation between the hepatorenal index and ultrasound attenuation coefficient for evalua–tion of hepatic steatosis. Radiation diagnostics, radiation therapy. 2024;15(1):35-42. https://doi.org/10.37336/2707-0700-2024-1-4.
- Sasso M, Tengher-Barna I, Ziol M, Miette V, Fournier C, Sandrin L, Poupon R, Cardoso AC, Marcellin P, Douvin C, de Ledinghen V, Trinchet JC, Beaugrand M. Novel controlled attenuation parameter for noninvasive assessment of steatosis using Fibroscan (R): Validation in chronic hepatitis C. J Viral Hepat. 2012;19(4):244-253. https://doi.org/10.1111/j.1365-2893.2011.01534.x.
- Song I, Thompson EW, Verma A, MacLean MT, Duda J, Elahi A, Tran R, Raghupathy P, Swago S, Hazim M, Bhattaru A, Schneider C, Vujkovic M, Torigian DA, Kahn CE, Gee JC, Bortha–kur A, Kripke CM, Carson CC, Carr R, Jehangir Q, Ko YA, Litt H, Rosen M, Mankoff DA, Schnall MD, Shou H, Chirinos J, Damrauer SM, Serper M, Chen J, Rader DJ; Penn Medicine BioBank; Witschey WRT, Sagreiya H. Clinical correlates of CT imaging-derived phenotypes among lean and overweight patients with hepatic steatosis. Sci Rep. 2024 Jan 2;14(1):53. doi: 10.1038/s41598-023-49470-x.
- Boyce CJ, Pickhardt PJ, Kim DH, Taylor AJ, Winter TC, Bruce RJ, Lindstrom MJ, Hinshaw JL. Hepatic steatosis (fatty liver disease) in asymptomatic adults identified by unenhanced low-dose CT. AJR Am J Roentgenol. 2010 Mar;194(3):623-8. doi: 10.2214/AJR.09.2590.
- Centers for Disease Control and Prevention, Interim Clinical Guidance for Management of Patients with Confirmed Coronavirus Disease (COVID‐19). Available from: https://www.cdc.gov/coronavirus/2019‐ncov/hcp/ clinical‐guidance‐management‐patients.html [Last accessed on 2020 Nov 29].
- Yoon SH, Lee KH, Kim JY, Lee YK, Ko H, Kim KH, Park CM, Kim YH. Chest Radiographic and CT Findings of the 2019 Novel Coronavirus Disease (COVID-19): Analysis of Nine Patients Treated in Korea. Korean J Radiol. 2020 Apr;21(4):494-500. doi: 10.3348/kjr.2020.0132.
- Xie H, Zhao J, Lian N, Lin S, Xie Q, Zhuo H. Clinical characteristics of non-ICU hospitalized patients with coronavirus disease 2019 and liver injury: A retrospective study. Liver Int. 2020 Jun;40(6):1321-1326. doi: 10.1111/liv.14449.
- Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, Zhang L, Fan G, Xu J, Gu X, Cheng Z, Yu T, Xia J, Wei Y, Wu W, Xie X, Yin W, Li H, Liu M, Xiao Y, Gao H, Guo L, Xie J, Wang G, Jiang R, Gao Z, Jin Q, Wang J, Cao B. Clinical features of patients infec–ted with 2019 novel coronavirus in Wuhan, China. Lancet. 2020 Feb 15;395(10223):497-506. doi: 10.1016/S0140-6736(20)30183-5.
- Mostovyi SYe, Zhaivoronok MM, Safonova OM. Ultrasound criteria for assessing the correction of metabolic-associated fatty liver disease and liver blood flow disorders using arginine in patients with coronary artery disease in combination with COVID-19. Gastroenterologìa. 2024;58(2):93-101. doi: 10.22141/2308-2097.58.2.2024.601
- Zhou YJ, Zheng KI, Wang XB, Sun QF, Pan KH, Wang TY, Ma HL, Chen YP, George J, Zheng MH. Metabolic-associated fatty liver disease is associated with severity of COVID-19. Liver Int. 2020 Sep;40(9):2160-2163. doi: 10.1111/liv.14575.
- Portincasa P, Krawczyk M, Smyk W, Lammert F, Di Ciaula A. COVID-19 and non-alcoholic fatty liver disease: Two intersecting pandemics. Eur J Clin Invest. 2020 Oct;50(10):e13338. doi: 10.1111/eci.13338.
- 2019 ESC Guidelines for the Diagnosis and Management of Chronic Coronary Syndromes: The Task Force for the Diagnosis and Management of Chronic Coronary Syndromes of the European Society of Cardiology (ESC). Ukrainian Journal of Cardiology. 2020 May;27(1):58-100. https://ucardioj.com.ua/index.php/UJC/article/view/209.