Журнал "Гастроэнтерология" Том 59, №1, 2025
Вернуться к номеру
Оцінка стану тонкокишкової мікробіоти, про- та протизапальних цитокінів, коротколанцюгових жирних кислот при метаболічно-асоційованій стеатотичній хворобі печінки в пацієнтів з імунною відповіддю на SARS-CoV-2
Авторы: Yu.M. Stepanov, V.I. Didenko, I.A. Klenina, O.M. Tatarchuk, O.P. Petishko, R.M. Kyslova
Institute of Gastroenterology of NAMSU, Dnipro, Ukraine
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
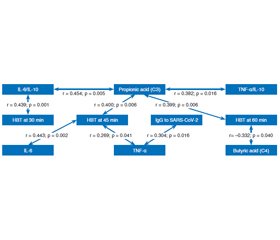
Актуальність. Мікробіота кишечника та її метаболіти мають значний вплив на патофізіологію захворювань печінки. Вона відіграє важливу роль у метаболізмі людини, підтримує слизовий бар’єр кишечника та взаємодіє з імунною системою. Епідемія COVID-19 призвела до значного збільшення в Україні кількості осіб, які страждають на метаболічно-асоційовану стеатотичну хворобу печінки (МАСХП). Однією з невирішених проблем, пов’язаних із МАСХП, є виявлення патогенетичних ланок, що впливають на ризик швидкого прогресування захворювання й розвитку незворотних змін у печінці. Дисбаланс у кишковій мікробіоті є тригером запуску патологічної реакції в органі. Мета: вивчити особливості вмісту про- та протизапальних цитокінів і коротколанцюгових жирних кислот при метаболічно-асоційованій стеатотичній хворобі печінки в пацієнтів з імунною відповіддю на SARS-CoV-2 залежно від стану тонкокишкової мікробіоти. Матеріали та методи. У дослідження було включено 61 особу з МАСХП: 41 чоловіка та 20 жінок віком від 18 до 73 років, середній показник становив (46,4 ± 1,5) року. Усім пацієнтам проведено визначення рівня IgG, специфічного до SARS-CoV-2, вмісту цитокінів (ІЛ-6, ІЛ-10, TNF-α) в сироватці крові за допомогою імуноферментного методу. Для оцінки стану тонкокишкової мікрофлори та синдрому надмірного бактеріального росту (СНБР) виконували водневий дихальний тест (ВДТ) із глюкозою. Рівень коротколанцюгових жирних кислот у калі визначали на хроматографі за методикою Guohua Zhao. Результати. У 44,3 % пацієнтів із МАСХП та імунною відповіддю на SARS-CoV-2 діагностований СНБР. Медіана рівня ІЛ-6 при СНБР вірогідно перевищувала контрольні значення — у 13,7 раза (р < 0,001), медіана TNF-α теж була вірогідно вищою — у 18,5 раза (р < 0,001). У групі СНБР значення TNF-α та ІЛ-6 були відповідно у 2 (р = 0,01) і 3,3 раза (р = 0,004) вищими порівняно з пацієнтами без СНБР. Медіана рівня оцтової кислоти (С2) при СНБР статистично вірогідно перевищувала контрольний показник — в 1,5 раза (р = 0,021). Медіана концентрації пропіонової кислоти (С3) була вірогідно вищою (в 1,4 раза; р = 0,003) у калі хворих із СНБР, ніж у пацієнтів без СНБР. Водночас за наявності СНБР спостерігалося зниження медіани масляної кислоти (С4) у 2,2 раза (р = 0,021) порівняно з групою без СНБР. Встановлено прямі кореляційні зв’язки між рівнем IgG, специфічних до SARS-CoV-2, і TNF-α (r = 0,304, р = 0,016); показником ВДТ на 45-й хвилині та рівнем TNF-α (r = 0,269, р = 0,041), ІL-6 (r = 0,443, р = 0,002), медіаною вмісту пропіонової кислоти (С3) (r = 0,400, р = 0,006). Одночасно виявлений зворотний кореляційний зв’язок між рівнем масляної кислоти (С4) та показником ВДТ на 60-й хвилині (r = –0,332, р = 0,040). Висновки. У пацієнтів із МАСХП з імунною відповіддю на SARS-CоV-2 при СНБР встановлено значне та вірогідне підвищення продукції прозапальних цитокінів на відміну від осіб без СНБР. Зареєстровано підвищений вміст оцтової кислоти та зниження масляної кислоти в калі пацієнтів із МАСХП з імунною відповіддю на SARS-CоV-2 за наявності СНБР. Порушення мікробного складу тонкокишкової мікробіоти, гіперпродукція прозапальних цитокінів та порушення синтезу коротколанцюгових жирних кислот є відмінними рисами МАСХП в осіб з імунною відповіддю на SARS-CоV-2.
Background. The intestinal microbiota and its metabolites have a significant impact on the pathophysiology of liver diseases, it plays an important role in human metabolism, supports the intestinal mucosal barrier and interacts with the immune system. The COVID-19 epidemic has led to a significant increase in the number of patients in Ukraine suffering from metabolic dysfunction-associated steatotic liver disease (MASLD). One of the unresolved problems associated with MASLD is the identification of pathogenetic links that affect the risk of rapid progression of the disease and the development of irreversible changes in the liver. An imbalance in the intestinal microbiota is a trigger for the launch of a pathological reaction in the liver. The purpose: to study the features of the content of pro- and anti-inflammatory cytokines and short-chain fatty acids in MASLD in patients with an immune response to SARS-CoV-2 depending on the small intestinal bacterial overgrowth (SIBO). Materials and methods. The study included 61 patients with MASLD, 41 men and 20 women aged 18 to 73 years, mean age (46.4 ± 1.5) years. All patients underwent determination of IgG specific to SARS-CoV-2, cytokine content (IL-6, IL-10, TNF-α) in serum by enzyme-linked immunosorbent assay. For the diagnosis of SIBO, a hydrogen breath test (HBT) with glucose was performed. Evaluation of short-chain fatty acids in faeces was performed on a chromatograph using the Guohua Zhao method. Results. In 44.3 % of patients with MASLD and an immune response to SARS-CoV-2, SIBO was diagnosed. The median value of IL-6 level in SIBO significantly exceeded the control values by 13.7 times (p < 0.001), the median of TNF-α was significantly higher by 18.5 times (p < 0.001). In SIBO group, the levels of TNF-α and IL-6 were, accordingly, 2 (p = 0.01) and 3.3 times (p = 0.004) higher compared to patients without SIBO. The median acetic acid (C2) level in the group with SIBO statistically significantly exceeded the control value by 1.5 times (p = 0.021). The median concentration of propionic acid (C3) was significantly higher by 1.4 times (p = 0.003) in the faeces of patients with SIBO than in those without it. At the same time, in the presence of SIBO, a decrease in the median of butyric acid (C4) was observed by 2.2 times (p = 0.021) compared to the group of patients without SIBO. Direct correlations were found between the levels of IgG specific to SARS-CoV-2 and TNF-α (r = 0.304, p = 0.016); the HBT index at 45 min and the level of TNF-α (r = 0.269, p = 0.041), IL-6 (r = 0.443, p = 0.002), the median of propionic acid (C3) content (r = 0.400, p = 0.006). At the same time, an inverse correlation was found between the level of butyric acid (C4) and the HBT index at 60 min (r = –0.332, p = 0.040). Conclusions. In patients with MASLD with an immune response to SARS-CoV-2 and SIBO, there was a significant increase in the production of proinflammatory cytokines, in contrast to patients without SIBO. An increased content of acetic acid and a decrease in butyric acid in the faeces of patients with MASLD with an immune response to SARS-CoV-2 in the presence of SIBO were found. Disturbance in the microbial composition of the small intestinal microbiota, hyperproduction of proinflammatory cytokines and impaired synthesis of short-chain fatty acids are distinctive features of MASLD in patients with an immune response to SARS-CoV-2.
метаболічно-асоційована стеатотична хвороба печінки; синдром надмірного бактеріального росту; запалення; цитокіни; коротколанцюгові жирні кислоти
metabolic dysfunction-associated steatotic liver disease; small intestinal bacterial overgrowth; inflammation; cytokines; short-chain fatty acids
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Didenko V, Klenina I, Tatarchuk O, Petishko O. Correlation of immunological and biochemical indicators in patients with chro–nic diffuse liver diseases depending on the etiological factors of steatosis and liver fibrosis. Gastroenterology. 2021;53(2):115-22. doi: 10.22141/2308-2097.53.2.2019.168985.
- Stepanov YM, Didenko VI, Klenina IA, Tatarchuk OM, Petishko OP. Metabolic abnormalities in patients with non-alcoholic fatty liver disease with immune response to SARS-CoV-2. Gastroenterology. 2024;58(1):25-30. doi: 10.22141/2308-2097.58.1.2024.583.
- Arab JP, Arrese M, Shah VH. Gut microbiota in non-alcoholic fatty liver disease and alcohol-related liver disease: Current concepts and perspectives. Hepatol Res. 2020;50(4):407-18. doi: 10.1111/hepr.13473.
- Wang L, Cao ZM, Zhang LL, Li JM, Lv WL. The role of gut microbiota in some liver diseases: From an immunological perspective. Front Immunol. 2022;13:923599. doi: 10.3389/fimmu.2022.923599.
- Jaworska K, Koper M, Ufnal M. Gut microbiota and renin-angiotensin system: A complex interplay at local and systemic levels. Am J Physiol Gastrointest Liver Physiol. 2021;321(4):G355-66. doi: 10.1152/ajpgi.00099.2021.
- Zaman CF, Sultana J, Dey P, et al. A multidisciplinary approach and current perspective of nonalcoholic fatty liver disease: A systematic review. Cureus. 2022;14(9):e29657. doi: 10.7759/cureus.29657.
- Ng CH, Wong ZY, Chew NWS, et al. Hypertension is prevalent in non-alcoholic fatty liver disease and increases all-cause and cardiovascular mortality. Front Cardiovasc Med. 2022;9:942753. doi: 10.3389/fcvm.2022.942753.
- Fajloun Z, Abi Khattar Z, Kovacic H, Legros CM, Sabatier JM. Anti-COVID-19 vaccination, COVID-19, and female contraception: The exacerbated risks (thromboembolism) of the estrogen-progestin pill. Infect Dis Drug Targets. 2023;23(4):e240223214000. doi: 10.2174/1871526523666230224094439.
- Ahmed J, Padam P, Ruban A. A retrospective analysis of patients on a waiting list for small intestinal bacterial overgrowth (SIBO) breath testing during the COVID-19 pandemic and introduction of a home testing pathway. United Eur Gastroenterol J. 2021;9(Suppl 8):342.
- Alharbi KS, Singh Y, Hassan Almalki W, et al. Gut micro–biota disruption in COVID-19 or post-COVID illness association with severity biomarkers: A possible role of pre/pro-biotics in manipulating microflora. Chem Biol Interact. 2022;358:109898. doi: 10.1016/j.cbi.2022.109898.
- Alberca GGF, Solis-Castro RL, Solis-Castro ME, Alberca RW. Coronavirus disease-2019 and the intestinal tract: An overview. World J Gastroenterol. 2021;27(13):1255-66. doi: 10.3748/wjg.v27.i13.1255.
- Shiri Aghbash P, Ebrahimzadeh Leylabadlo H, Fathi H, Bahmani M, Chegini R, Bannazadeh Baghi H. Hepatic disorders and COVID-19: From pathophysiology to treatment stra–tegy. Can J Gastroenterol Hepatol. 2022;2022:4291758. doi: 10.1155/2022/4291758.
- Guo GJ, Yao F, Lu WP, Xu HM. Gut microbiome and meta–bolic-associated fatty liver disease: Current status and potential applications. World J Hepatol. 2023;15(7):867-82. doi: 10.4254/wjh.v15.i7.867.
- Contes-Cal TCM, Mattos RT, Medeiros NI, et al. Crosstalk between plasma cytokines, inflammation, and liver damage as a new strategy to monitor NAFLD progression. Front Immunol. 2021;12:708959. doi: 10.3389/fimmu.2021.708959.
- Mussabay K, Kozhakhmetov S, Dusmagambetov M, et al. Gut microbiome and cytokine profiles in post-COVID syndrome. Viruses. 2024;16(5):722. doi: 10.3390/v16050722.
- Portincasa P, Krawczyk M, Smyk W, Lammert F, Di Ciaula A. COVID-19 and non-alcoholic fatty liver disease: Two intersecting pandemics. Eur J Clin Invest. 2020;50(10):e13338. doi: 10.1111/eci.13338.
- Montori M, Baroni GS, Santori P, et al. Liver damage and COVID-19: At least a “two-hit” story in systematic review. Curr Issues Mol Biol. 2023;45(4):3035-47. doi: 10.3390/cimb45040199.
- Buchynskyi M, Kamyshna I, Oksenych V, Zavidniuk N, Kamyshnyi A. The intersection of COVID-19 and metabolic-associated fatty liver disease: An overview of the current evidence. Viruses. 2023;15(5):1072. doi: 10.3390/v15051072.
- Jeeyavudeen MS, Chaudhari R, Pappachan JM, Fouda S. Clinical implications of COVID-19 in patients with metabolic-associa–ted fatty liver disease. World J Gastroenterol. 2023;29(3):487-502. doi: 10.3748/wjg.v29.i3.487.
- Vasques-Monteiro IML, Souza-Mello V. Coronavirus disease 2019 severity in obesity: Metabolic dysfunction-associated fatty liver disease in the spotlight. World J Gastroenterol. 2021;27(16):1738-50. doi: 10.3748/wjg.v27.i16.1738.
- Xu Y, Yang X, Bian H, Xia M. Metabolic dysfunction-associated fatty liver disease and coronavirus disease 2019: Clinical relationship and current management. Lipids Health Dis. 2021;20(1):126. doi: 10.1186/s12944-021-01564-z.
- Zhou B, Pang X, Wu J, Liu T, Wang B, Cao H. Gut microbiota in COVID-19: New insights from inside. Gut Microbes. 2023;15(1):2201157. doi: 10.1080/19490976.2023.2201157.