Вступ
Субклінічна та соматизована тривога є поширеним явищем у пацієнтів із хронічними соматичними захворюваннями. Згідно з низкою досліджень, субклінічна тривога може виявлятися у приблизно 35 % пацієнтів з хронічною мігренню та хронічним головним болем напруги [2], у 7–37 % пацієнтів з автоімунним тиреоїдитом [7], у 32 % пацієнтів з анкілозуючим спондилоартритом та у 36 % пацієнтів з подагрою [13]. Така «прихована» коморбідна тривожність може становити серйозний виклик для системи охорони психічного здоров’я.
Прояви тривоги субклінічного рівня зазвичай недостатньо виражені, щоб виправдати призначення стандартної фармакотерапії (антидепресантів або бензодіазепінів). Застосування цих засобів у пацієнтів з легкими тривожними симптомами обмежується через побічні ефекти та ризик звикання й необхідність короткострокового курсу при лікуванні бензодіазепінами [8].
У зв’язку з цим зростає інтерес до альтернативних анксіолітиків із кращим профілем безпеки. Попередні дослідження виявили, що денний транквілізатор фабомотизол у дозуванні 30 мг позитивно впливає на психічні та соматичні прояви тривоги, а також якість життя пацієнтів із соматоформною вегетативною дисфункцією [11]. Фабомотизол виявляє плавне, проте стабільне збільшення протитривожного ефекту, зменшує соматичні прояви тривоги та поліпшує якість життя протягом місяця прийому, що потенційно робить його оптимальним для довгострокового прийому.
Порівняно з бензодіазепіновими анксіолітиками, які проявляють швидку протитривожну дію, проте мають рекомендовану тривалість застосування від 2 до 4 тижнів, можливість тривалої дії фабомотизолу при низькій частоті виникнення побічних ефектів дозволяє говорити про його перспективність як препарату тривалого прийому. Водночас дані щодо дозозалежності ефектів цього препарату при тривалому застосуванні залишаються обмеженими. Це свідчить про необхідність подальших досліджень довготривалої ефективності й безпеки фабомотизолу у пацієнтів із соматизованою та субклінічною тривогою.
Метою цього дослідження було порівняти ефективність та безпечність тривалого прийому (протягом 3 місяців) фабомотизолу в різних добових дозах у пацієнтів із субклінічною та соматизованою тривогою.
Матеріали та методи
Досліджувана популяція. Дослідження проводилось на базі психоневрологічного відділення Дорожньої клінічної лікарні № 1. Було обстежено 90 пацієнтів з субклінічною та соматизованою тривогою, яких розподілено у три групи по 30 осіб.
Скринінгові процедури. У період набору пацієнтів проводилося скринінгове тестування за допомогою самоопитувальника «Шкала самооцінки тривоги» [12] та госпітальної шкали тривоги й депресії HADS [10]. Після обстеження у випробування включалися пацієнти, що дали письмову інформовану згоду на участь в дослідженні і відповідали критеріям включення.
Критерії включення: 1) письмова згода на участь у дослідженні; 2) вік ≥ 18 років; 3) діагностована субклінічна або соматизована тривога на момент скринінгу; 4) відсутність даних про істотне структурне чи функціональне порушення зазначеного органа чи системи; 5) симптоми захворювання тісно пов’язані з неприємними життєвими обставинами, труднощами та конфліктами; 6) заклопотаність і засмученість із приводу можливого серйозного (але часто невизначеного) захворювання цього органа чи системи, причому повторні пояснення і переконання лікарів стосовно цього залишаються безрезультатними; 7) пацієнти повинні бути згодні не включати в схему усі непередбачені дослідженням препарати для лікування тривожних розладів, за винятком «препаратів екстреної допомоги»;
8) пацієнти повинні мати бажання і бути спроможні дотримуватись способу життя, що вимагається від них у рамках дослідження, розкладу візитів, плану лікування, розкладу лабораторних аналізів, інструментального обстеження та інших процедур дослідження.
Критерії невключення: 1) вагітні жінки, жінки у період лактації, жінки, у яких є підозра на вагітність, та жінки, які планують завагітніти у період проведення клінічного дослідження; 2) діти до 18 років; 3) хірургічне втручання, що планується у період проведення дослідження; 4) тяжка або повна інвалідизація (наприклад, пацієнт, прикутий до ліжка або інвалідного візка, який має мінімальну можливість або не має можливості самообслуговування); 5) анамнестичні дані, встановлений діагноз, ознаки або симптоми клінічно значущого психічного захворювання; 6) застосування седативних засобів, транквілізаторів, антидепресантів протягом 30 днів, що передують візиту рандомізації; 7) будь-який інший стан, який, за думкою лікаря-дослідника, створить для пацієнта підвищений ризик для здоров’я або з будь-яких інших причин зробить пацієнта непідходящим кандидатом для участі в даному дослідженні.
Після скринінгу учасників було випадковим чином (шляхом простої рандомізації) розподілено до однієї із трьох груп дослідження:
— група 1 — учасники цієї групи приймали фабомотизол у таблетках (препарат Бафазол IC® виробництва ТОВ «Інтерхім») за схемою: по 10 мг 3 рази на день протягом 90 днів;
— група 2 — учасники цієї групи приймали фабомотизол у таблетках (препарат Бафазол IC® виробництва ТОВ «Інтерхім») за схемою: по 20 мг 3 рази на день протягом 30 днів, надалі по 10 мг 3 рази на день протягом 60 днів;
— група 3 — учасники цієї групи приймали фабомотизол у таблетках (препарат Бафазол IC® виробництва ТОВ «Інтерхім») за схемою: по 20 мг 3 рази на день протягом 90 днів.
Оцінка ефективності. Оцінка ефективності порівнюваних схем лікування проводилася на основі наступних показників:
1. Вираженість тривожних розладів за шкалою тривоги Гамільтона НАМ-А [5].
2. Вираженість дистресу, депресії, тривоги та соматизації за чотиривимірним опитувальником симптомів 4DSQ [9].
3. Суб’єктивна оцінка якості життя за шкалою оцінки рівня якості життя CQLS [3].
Часові точки. Показники вимірювались на 1-й день дослідження, 7, 14, 30, 60, 90, 105 та 120-й дні дослідження.
Оцінка безпечності. Переносимість препарату оцінювалася на підставі суб’єктивних відчуттів, що повідомлялися пацієнтом лікарю, і об’єктивних даних, отриманих дослідником у процесі лікування. Враховувалися дані клінічного обстеження, а також частота виникнення і характер побічних реакцій.
Переносимість препарату оцінювалася за наступною шкалою:
1. Хороша — не відзначалися або спостерігалися поодинокі легкі побічні реакції, які не впливали на працездатність і звичайний характер життєдіяльності пацієнта.
2. Задовільна — спостерігалися незначні побічні реакції, що легко переносились пацієнтом, не заподіяли йому серйозних проблем і не потребували відміни препарату.
3. Незадовільна — мали місце небажані побічні реакції, що справляли значний негативний вплив на стан хворого, потребували відміни препарату та/або застосування додаткових медичних заходів.
У разі виникнення виражених побічних ефектів у більшості (> 50 %) пацієнтів проведення дослідження було б припинено достроково.
Для кожного конкретного пацієнта підставами до припинення участі в дослідженні були:
— індивідуальна непереносимість досліджуваного препарату;
— виникнення у пацієнта в ході дослідження тяжких побічних явищ;
— значне погіршення загального стану в період дослідження;
— відмова пацієнта від участі в дослідженні.
Етичні аспекти дослідження. Дослідження проведено відповідно до принципів Гельсінської декларації. Участь кожного пацієнта у дослідженні була абсолютно добровільною. Пацієнт надавав згоду на участь у дослідженні після того, як йому доступно роз’яснювалась вичерпна інформація про мету та завдання дослідження, про користь, можливі ризики та побічні ефекти лікування. Пацієнт мав право відмовитись від участі в дослідженні на будь-якому етапі без пояснення причини відмови, що не впливало на ставлення до нього медичного персоналу.
Методи статистичної обробки. Описова статистика була наведена через середнє значення ± стандартне відхилення. Для оцінки різниці між групами на кожній часовій точці було використано дисперсійний аналіз (ANOVA) з попарними порівняннями за допомогою тесту Тьюкі. Розмір ефекту кожної групи порівняно з іншою групою вимірювався за допомогою тесту Коена та розрахунку d-значення. Різниця між групами у розподілі якісних показників вимірювалась за допомогою тесту 2 Пірсона. Значущість різниці між групами у динаміці показників вимірювалась за допомогою дисперсійного аналізу повторних вимірювань (RM-ANOVA). Додатково різниця загального бала HAM-A (як показника основного інтересу) між 105-м та 0-м днем, а також між 120-м та 0-м днем у межах кожної групи оцінювалась за допомогою тесту Вілкоксона для пов’язаних вибірок. При візуалізації динаміки точкова оцінка супроводжувалась означенням 95% довірчого інтервалу (ДІ). Показник p < 0,05 було встановлено як статистично значущий. Аналіз даних кодувався мовою програмування python 3.13.0 (із використанням бібліотек numpy, pandas, scipy, statsmodels, mathplotlib, seaborn).
Результати
Середній вік вибірки (n = 90) становив 38,42 ± 11,43 року, без статистично значущих відмінностей між групами (p = 0,456). Усі групи мали подібний розподіл за статтю: жінки становили 56,67 % всієї вибірки, а чоловіки — 43,33 %, p = 0,665. Переважна більшість учасників мала вищу освіту (83,33 %), що також не відрізнялося між групами (p = 0,787). За сімейним статусом 68,89 % усіх учасників перебували у шлюбі, 31,11 % — поза шлюбом; статистично значущих відмінностей між групами за цими показниками також не було виявлено (p = 0,510) (табл. 1).
Ці результати свідчать про успішну рандомізацію та початкову однорідність груп за ключовими демографічними змінними.
У ході дослідження встановлено дозозалежну ефективність препарату фабомотизол при лікуванні субклінічної та соматизованої тривоги, що відображено в динаміці зниження симптомів тривоги, дистресу, соматизації, депресії та поліпшенні якості життя протягом усього курсу лікування (3 місяці).
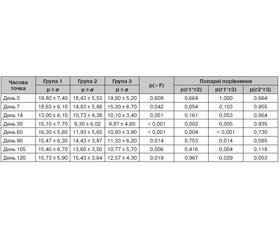
Табл. 2 демонструє динаміку рівня тривоги у пацієнтів за шкалою тривоги Гамільтона (HAM-A) протягом усього періоду спостереження залежно від дозування фабомотизолу. Вихідні значення рівня тривоги були подібними у всіх групах, що підтверджується відсутністю статистично значущих відмінностей між ними на початку дослідження (р = 0,636).
/22.jpg)
Починаючи вже з другого тижня (день 14) спостерігалися виражені статистично значущі відмінності між групами (р < 0,001). Це свідчить про швидше та більш виражене зменшення симптомів тривоги у пацієнтів, які приймали фабомотизол у вищих дозах (групи 2 та 3), порівняно з пацієнтами, які отримували препарат у стандартному дозуванні (група 1). Така тенденція продовжувала зберігатися і на наступних етапах спостереження (день 30, 60 і 90), про що свідчать стабільно низькі середні значення балів тривоги в групах з більшими дозуваннями. Після завершення лікування спостерігалося деяке підвищення рівня тривоги в усіх групах. Досягнуті раніше результати залишалися кращими у групах з високими дозуваннями (групи 2 і 3), хоча різниця між групами була вже статистично незначущою (дні 105 і 120, p > 0,05). Це свідчить про тривале збереження терапевтичного ефекту після завершення прийому препарату, яке, ймовірно, є дозонезалежним.
Попарні порівняння загального бала за шкалою HAM-A продемонстрували статистично значущу різницю між групами в кількох часових точках. Найвираженіші відмінності спостерігалися на 14-й день, коли група 1 мала значущо вищі бали тривоги порівняно з групою 2 (p < 0,001) та групою 3 (p < 0,001), що свідчить про вищий рівень тривоги у групі 1 на цьому етапі. Значущої різниці між групою 2 та групою 3 на цьому етапі не було виявлено. Подібна, але менш виражена картина спостерігалась на 30-й день, коли різниця між групою 1 і групами 2 та 3 також була статистично значущою (p = 0,028 та p = 0,008 відповідно). Значущої різниці між групою 2 та групою 3 на цьому етапі також не було виявлено, що свідчить про подібність лікувального ефекту. На 60-й і 90-й день значущість зберігалася лише для порівняння групи 1 з групою 3 (p = 0,011 для обох точок), тоді як різниця між групою 1 і 2 перестала бути статистично значущою (p > 0,05), так само як не була значущою і різниця між групою 2 та 3 (p > 0,05). Це може свідчити про поступове вирівнювання показників групи 2 до рівня групи 1 через перехід на однакове дозування (30 мг/добу). В інших часових точках (дні 0, 7, 105, 120) жодні попарні порівняння не досягли статистичної значущості, що вказує на відсутність виражених міжгрупових відмінностей у ці моменти. Певне збільшення загального бала HAM-A та відсутність статистично значущої різниці між групами на 105-й та 120-й дні може вказувати на регресію до середнього після припинення прийому препарату та однакову стабільність ефекту незалежно від дозування.
Тепловий графік демонструє різницю величини ефекту (d Коена) за шкалою HAM-A між трьома групами учасників у різні часові точки. Найбільша різниця спостерігається на 14-й день, особливо у порівнянні групи 1 з групою 3 (d = 1,75), що вказує на значну різницю у зниженні рівня тривоги. Помірно-сильна різниця між цими групами зберігається до 90-го дня (d ≈ 0,75–0,80), після чого спостерігається поступове зниження різниці в розмірі ефекту. Порівняння між групами 2 і 3 демонструє переважно малу або помірну різницю в розмірі ефекту впродовж усього періоду, що свідчить про схожість їх динаміки. Отримані дані підтверджують перевагу втручання, застосованого в групі 3, порівняно з втручанням у групі 1, у зниженні тривоги на ранніх та середніх етапах (рис. 1).
Табл. 3 демонструє результати дисперсійного аналізу повторних вимірювань за загальним балом HAM-A, що дозволяє оцінити вплив дозування препарату (фактор «Група»), часу (фактор «Час»), а також взаємодії між цими двома факторами («Група*Час») на динаміку симптомів тривоги.
Аналіз виявив статистично значущий вплив фактора «Група» (р < 0,001), що свідчить про відмінності в рівні тривоги залежно від прийнятої добової дози препарату. Також встановлено значущість впливу фактора «Час» (р < 0,001), що відображає виражену та значущу динаміку показників тривоги в усіх групах протягом усього періоду спостереження порівняно зі стартовим рівнем. Крім того, зафіксована статистично значуща взаємодія між факторами «Група*Час» (р = 0,035), що свідчить про дозозалежність темпів та характеру зменшення симптомів тривоги при прийомі фабомотизолу — більш виражені позитивні зміни відзначалися у групах з більшим дозуванням препарату (рис. 2).
Таким чином, отримані результати підтверджують виражену дозозалежну ефективність фабомотизолу у лікуванні тривожних розладів. Найбільш значуще зниження симптомів тривоги спостерігалося з 14-го дня при застосуванні дозування 60 мг/добу. Цей ефект стабільно зберігався протягом усього періоду лікування (до 90 днів).
До 105-го дня рівень тривоги дещо підвищився, проте досягнуте поліпшення стану продовжувало зберігатися в зоні межових значень, вказуючи на стабільність терапевтичного ефекту протягом певного часу (мінімум протягом місяця) по завершенню лікування. Подібне коливання може бути явищем регресії до середнього, тобто природною тенденцією значень повертатися до усередненого рівня після досягнення екстремальних значень під час лікування. Крім того, слід враховувати можливість випадкових коливань у контексті невеликої вибірки або індивідуальних особливостей пацієнтів.
Важливо відзначити, що навіть за умов незначного підвищення досягнуте поліпшення стану продовжує зберігатися в зоні межових значень (6–13 балів), що вказує на стабільність терапевтичного ефекту. Окрім того, загальний бал HAM-A на 105-й та 120-й дні статистично значуще відрізнявся від бала на момент залучення в дослідження (p < 0,001 в обох випадках) для всіх трьох груп (табл. 4).
Це дозволяє припустити, що фабомотизол забезпечує тривале зниження рівня тривоги навіть після завершення курсу лікування.
Найефективнішою у зменшенні тривоги виявилась схема лікування із дозою 60 мг/добу протягом усього курсу лікування.
Разом з тим лікування початковою дозою 60 мг/добу з наступним переходом на підтримувальну дозу 30 мг/добу може виявитись більш економічно ефективним, ніж прийом 60 мг/добу протягом усього періоду лікування, через швидше зменшення вираженості тривоги порівняно зі стандартним дозуванням, оптимальний баланс ефективності й переносимості та стійкий ефект після завершення лікування, що можна порівнювати з ефектом від постійного прийому 60 мг/добу.
Табл. 5 демонструє динаміку соматизації тривоги за чотиривимірним опитувальником симптомів (4DSQ) протягом усього періоду спостереження залежно від дозування фабомотизолу. Вихідні значення рівня соматизації тривоги були дещо різними в групах, з найбільшим значенням у групі 3, що підтверджується наявністю статистично значущих відмінностей між групами на початку дослідження (р = 0,036).
З другого тижня спостереження (день 14) відмічалися суттєві статистично значущі відмінності між групами (р = 0,007), особливо між групою 1 (стандартне дозування 30 мг/добу) та групою 2 (дозування 60 мг/добу, р = 0,005). Це свідчить про вираженіше та швидше зменшення соматичних симптомів тривоги саме в пацієнтів, які отримували вищу дозу препарату на початковому етапі. Тенденція до збереження значущих міжгрупових відмінностей зберігалася на 30, 60, 90 та 105-й дні спостереження (р < 0,001), із загальним поліпшенням стану саме у групах з вищими дозуваннями (особливо група 3). На 120-й день статистично значущої різниці між групами не було виявлено.
Попарні порівняння демонструють, що найбільш виражені та стабільні відмінності спостерігалися між групою 1 та групою 3 (дні 30, 60, 90, 105, р < 0,01), що підкреслює перевагу схеми із високим дозуванням. На день 60 також була значуща відмінність між групою 1 та групою 2 (р < 0,001). Водночас на заключних етапах (105-й і 120-й день) спостерігалося поступове зростання середніх значень соматизації тривоги в усіх групах, що призвело до відсутності статистично значущих міжгрупових відмінностей на 120-й день (р = 0,598). Це може свідчити про певне повернення симптомів після завершення лікування, незалежно від дозування препарату.
Тепловий графік (рис. 3) демонструє зміни величини ефекту (d Коена) між трьома досліджуваними групами за шкалою соматизації 4DSQ у різні часові точки. Найбільші відмінності зафіксовано на 60-й день між групою 1 та групою 2 (d = 1,26), а також між групою 1 та групою 3 на 30, 90 та 105-й день (d = 1,23, 1,03 та 1,08 відповідно), що свідчить про виражену різницю в рівні соматичних симптомів. У більшості часових точок група 1 демонструє вищі показники соматизації порівняно з іншими групами. Водночас порівняння між групами 2 і 3 здебільшого виявляє помірну або малу різницю, за винятком 90-го та 105-го дня (d = 0,75 і 0,49). Початкова (день 0) та фінальна (день 120) різниця є низькою, що свідчить про мінімальні відмінності на початку та у кінці дослідження.
Отже, отримані дані підтверджують дозозалежну перевагу фабомотизолу щодо зниження соматичних проявів тривоги, особливо при використанні схем лікування з вищою дозою (60 мг/добу). Довгострокова ефективність у стабілізації результату після завершення курсу лікування є помірною і дозонезалежною.
Табл. 6 демонструє результати дисперсійного аналізу повторних вимірювань за загальним балом соматизації тривоги (за опитувальником 4DSQ), який був проведений для оцінки впливу дозування препарату (фактор «Група»), впливу часу (фактор «Час») та їх взаємодії («Група*Час») на симптоматику соматизації тривоги.
Аналіз виявив статистично значущий вплив фактора «Група» (р < 0,001), що свідчить про суттєві відмінності між групами пацієнтів, які отримували різні дозування фабомотизолу. Це підтверджує висновок про дозозалежний ефект препарату. Також був виявлений високо значущий ефект фактора «Час» (р < 0,001), що вказує на суттєву динаміку зниження рівня соматизації тривоги у пацієнтів всіх досліджуваних груп протягом періоду лікування.
Важливим результатом є наявність статистично значущої взаємодії між дозуванням препарату та часом («Група*Час», р < 0,001). Це означає, що зміни рівня соматизації тривоги з плином часу істотно залежали від дозування фабомотизолу. Більші дози (зокрема, схема з прийомом 60 мг на добу) забезпечували більш виражене та швидке зменшення соматизації симптомів порівняно зі стандартним дозуванням (рис. 4).
Отже, результати дисперсійного аналізу повністю узгоджуються з попередніми спостереженнями описової статистики і підтверджують, що схема лікування з вищими початковими дозами фабомотизолу є значно ефективнішою щодо швидкості настання ефекту, глибини та стабільності зменшення соматичних симптомів тривоги у пацієнтів із тривожними станами.
Динаміка рівня дистресу за чотиривимірним опитувальником симптомів (4DSQ) у пацієнтів, що отримували різні дози фабомотизолу, протягом усього періоду спостереження наведена у табл. 7.
На старті дослідження (день 0) значення дистресу були приблизно однаковими в усіх трьох групах, що підтверджується відсутністю статистично значущих відмінностей (р = 0,609). Це свідчить про початкову порівнянність груп за цим показником.
На ранніх етапах терапії (день 7 і 14) спостерігалася лише тенденція до зниження дистресу в групах з вищими дозами препарату, однак міжгрупові відмінності ще не були значущими. Починаючи з 30-го дня стають помітними чіткі статистично значущі переваги в групах 2 та 3 порівняно з групою 1. Зокрема, на 30-й день ди-стрес значущо нижчий у пацієнтів, які отримували вищі дози фабомотизолу (р = 0,002 для групи 2, р = 0,005 для групи 3), і ця відмінність утримувалася до 60-го дня.
У подальшому, з 90-го дня, динаміка в групі 2 дещо вирівнялася відносно групи 1, що може бути наслідком зниження дози препарату. Натомість у групі 3, де застосовувалась комбінація високої початкової та підтримувальної дози, ефект залишається вираженим довше — статистично значущі відмінності з групою 1 спостерігаються навіть на 105-й (р = 0,004) та 120-й день (р = 0,029). Водночас різниця між групами 2 і 3 протягом усього періоду лікування здебільшого не досягала статистичної значущості, що вказує на близьку ефективність цих схем.
Тепловий графік (рис. 5) демонструє динаміку рівня дистресу за шкалою 4DSQ у трьох групах учасників на різних етапах дослідження. Найвищу величину ефекту (d = 1,11) виявлено між групами 1 та 3 на 60-й день, що свідчить про значну різницю у вираженості дистресу. Група 1 стабільно демонструє вищі показники дистресу порівняно з групою 3 упродовж усього періоду спостереження (d > 0,6) у більшості часових точок після 30-го дня. Порівняння між групами 1 та 2 також виявляє помірні ефекти в середині дослідження, тоді як група 2 порівняно з групою 3 демонструє поступове збільшення різниці в розмірі ефекту до завершення дослідження (день 120), що може свідчити про кумулятивну різницю у динаміці зниження дистресу.
Табл. 8 демонструє результати дисперсійного аналізу повторних вимірювань за субшкалою дистресу (за 4DSQ), що дозволяє оцінити вплив дозування препарату (фактор «Група»), часу (фактор «Час») та їх взаємодії («Група*Час») на динаміку рівня дистресу протягом лікування.
Аналіз виявив статистично значущий вплив фактора «Група» (р < 0,001), що підтверджує наявність значних міжгрупових відмінностей у рівні дистресу залежно від застосованої дози фабомотизолу. Пацієнти, які отримували вищі дози препарату, продемонстрували більш виражене зменшення дистресу порівняно з групою 1.
Також встановлено значущий вплив фактора «Час» (р < 0,001), що свідчить про значну динаміку зниження рівня дистресу в усіх групах протягом курсу лікування. Показники поліпшувалися з часом, що вказує на тривалий ефект препарату (рис. 6).
Однак взаємодія між дозою та часом (р = 0,088) не досягла статистичної значущості, що може свідчити про те, що ефект дистресу не має чітко вираженого дозозалежного компонента в динаміці на всіх етапах лікування. Це вказує на те, що хоча більші дози препарату значно знижують рівень дистресу, цей ефект не завжди лінійно змінюється залежно від часу лікування.
Отже, результати підтверджують, що підвищені дози фабомотизолу мають значний позитивний вплив на зменшення рівня дистресу в пацієнтів, але взаємодія між дозою та часом лікування не є досить вираженою для того, щоб говорити про чітко дозозалежну динаміку цього ефекту.
Табл. 9 відображає зміни рівня депресії (за 4DSQ) у пацієнтів, що отримували різні дози фабомотизолу, протягом усього курсу лікування.
Протягом першого тижня між групами не спостерігалося статистично значущих відмінностей за рівнем депресії (р > 0,05), що може свідчити про однаковий рівень симптомів депресії в усіх групах на початку лікування. На 14-й день спостерігалася тенденція до зменшення симптомів депресії в групах 2 та 3 порівняно з групою 1, однак міжгрупові відмінності залишалися статистично незначущими (р > 0,05). Також на наступних етапах (день 30, 60, 90) різниця між групами не досягала статистичної значущості (р > 0,05), що вказує на подібні темпи поліпшення стану в усіх групах, без явної переваги однієї з них. На 120-й день лікування спостерігалася статистично значуща різниця між групами 1 та 3 (р = 0,015), що може свідчити про кращі результати в групі 3 (яка отримувала схему з початковою дозою 60 мг/добу та наступним прийомом 60 мг/добу) порівняно з групою 1, де використовувалася стандартна доза. Водночас різниця між групою 2 та групою 3 була статистично незначущою (р = 0,565), що вказує на подібні результати цих двох груп. Одночасна відсутність статистично значущої різниці між групою 1 та групою 2 говорить про те, що результати групи 2 були проміжними щодо ефективності між групою 1 та групою 3.
Тепловий графік (рис. 7) демонструє відносно невеликі міжгрупові відмінності у розмірі протидепресивного ефекту упродовж періоду спостереження. Найбільша різниця спостерігалася між групою 1 та групою 3 на 105-й день (d = 0,58) та 120-й день (d = 0,72), що може свідчити про поступове наростання відмінностей у динаміці зменшення депресивних симптомів. Помірна різниця між групою 1 та групою 2 фіксувалася з 60-го дня і зберігалася до завершення дослідження (d ≈ 0,47–0,48). Порівняння групи 2 з групою 3 виявили незначущі або низькі ефекти на всіх етапах, що свідчить про подібну динаміку у цих групах.
Табл. 10 надає результати дисперсійного аналізу повторних вимірювань за субшкалою депресії (за 4DSQ), що оцінює вплив дозування препарату, часу та їх взаємодії на зміну рівня депресії протягом лікування.
Спостерігався статистично значущий вплив фактора «Група» (р = 0,042), що свідчить про різницю у рівні депресії між групами з різними дозуваннями фабомотизолу. Пацієнти, які отримували більші дози препарату, продемонстрували кращі результати в зменшенні депресивних симптомів порівняно з групою, що отримувала стандартну дозу. Фактор «Час» також виявився значущим (р < 0,001), що підтверджує наявність вираженої динаміки поліпшення стану пацієнтів протягом лікування в усіх групах, а отже, депресивні симптоми зменшувалися з часом у всіх пацієнтів. Однак взаємодія між факторами «Група» і «Час» виявилась статистично незначущою (р = 0,215). Це може свідчити про те, що ефект зниження депресії не залежав від конкретного часу лікування, і всі групи демонстрували подібні результати зменшення симптомів, навіть якщо лікування проводилося з різним дозуванням.
Таким чином, фабомотизол ефективно зменшує депресивні симптоми, але дозування не має чіткої дозозалежної взаємодії з часом лікування (рис. 8).
Різниця між групами не була статистично значущою на більшості етапів, і поліпшення симптомів депресії спостерігалося в усіх групах без чіткої переваги більш високих доз. Це може вказувати на те, що вищі дози не призвели до більш вираженого поліпшення порівняно з нижчими дозами.
Табл. 11 надає описову статистику змін рівня тривоги за шкалою 4DSQ в різних групах пацієнтів, які отримували різні дози фабомотизолу, протягом лікування. Початкові значення рівня тривоги були схожими у всіх групах, без значущих відмінностей (р = 0,505), що вказує на рівномірний старт дослідження для всіх груп.
Однак вже на 7-й день лікування результати значно відрізняються. Групи з вищими дозами фабомотизолу (групи 2 та 3) демонстрували значно знижену тривогу порівняно з групою 1 (р < 0,001 для обох порівнянь), що свідчить про швидкий ефект вищих доз. Водночас різниця між групами 2 та 3 не була значущою (р = 0,904), що означає, що їхній протитривожний ефект є подібним. На 14-й день результати всіх трьох груп дещо стабілізувалися, і хоча тривога продовжувала знижуватись, статистично значущі відмінності не спостерігалися. Це може свідчити про поступове вирівнювання ефекту на пізніших етапах лікування, хоча загалом високі дози продовжували мати перевагу. У наступні точки контролю (30-й і 60-й день) рівень тривоги в групах 2 та 3 залишався значно нижчим, ніж у групі 1, що підтверджується статистично значущими відмінностями (р < 0,001). Цей ефект стабільно зберігався до 60-го дня, але між групами 2 та 3 різниця не була виявлена (р = 1,000), що вказує на подібну ефективність цих схем у зниженні тривоги. На 90-й день різниця між групами 1 та 3 знову була статистично значущою (р < 0,001), тоді як різниця між групами 1 і 2 зменшилася і перестала бути значущою (р = 0,306). Це може свідчити про певне вирівнювання ефектів у групах через зменшення дозування у групі 2 до аналогічного в групі 1 через місяць лікування. Спостерігалась статистично значуща різниця між групою 2 та групою 3, що може свідчити про те, що ефект від схеми у групі 2 на 90-й день вже був подібніший до ефекту від схеми лікування у групі 1, ніж у групі 3. На 105-й та 120-й день рівень тривоги в усіх групах наблизився до однакових значень, і різниця між групами стала статистично незначущою (р > 0,05). Це може свідчити про стабільний ефект, досягнутий у всіх групах, та регресію до середнього після завершення лікування.
/31.jpg)
Тепловий графік розміру ефекту (рис. 9) демонструє динаміку міжгрупових відмінностей у рівні тривоги за шкалою 4DSQ упродовж дослідження. Найбільші ефекти зафіксовано у порівняннях групи 1 з групами 2 та 3 у ранніх і середніх часових точках (день 7 і 30, d > 1,0), що свідчить про значно менше зниження рівня тривоги в групі 1 порівняно з іншими. Пік різниці ефекту спостерігався на 90-й день між групою 1 та групою 3 (d = 1,18). Група 2 порівняно з групою 3 демонструвала незначні відмінності протягом більшості часу, однак до 90-го та 120-го дня різниця в ефекті помітно зростала.
Таким чином, високі дози фабомотизолу, особливо на ранніх етапах лікування, призводили до більш швидкого та вираженого зниження рівня тривоги, проте з часом, по завершенню курсу лікування, різниця між групами зменшувалася. Це вказує на те, що вищі дози забезпечують швидший початковий ефект, але після лікування пацієнти з будь-якими дозами досягають стабільних результатів протягом як мінімум місяця.
Табл. 12 відображає результати дисперсійного аналізу повторних вимірювань за субшкалою тривоги (за 4DSQ).
Аналіз показав статистично значущий вплив фактора «Група» (р < 0,001), що свідчить про значні відмінності в рівні тривоги між групами з різними дозами фабомотизолу. Пацієнти, які отримували вищі дози препарату, продемонстрували кращі результати в зниженні тривоги, що підтверджує ефективність препарату залежно від дозування. Також встановлено статистично значущий вплив фактора «Час» (р < 0,001), що підтверджує виражену динаміку рівня тривоги у всіх групах протягом лікування. Цей результат свідчить про поступове зменшення тривоги з часом у всіх групах пацієнтів, що підтверджує значущий тривалий ефект фабомотизолу. Крім того, було виявлено статистично значущу взаємодію між факторами «Група» і «Час» (р = 0,003). Це вказує на те, що темп зменшення тривоги може відрізнятися залежно від початкової дози препарату, що підкреслює дозозалежність терапевтичного ефекту фабомотизолу (рис. 10).
На початковому етапі (день 0) значення якості життя в усіх групах були подібними, без статистично значущих відмінностей між ними (р = 0,913), що підтверджує однаковість показників до початку лікування та успішність рандомізації (табл. 13).
Уже на 7-й день пацієнти з вищими дозами (групи 2 і 3) продемонстрували значно кращі результати (р = 0,027 для групи 1 і 3), хоча різниця між групами 2 і 3 не була значущою (р = 0,948). Подальше поліпшення якості життя спостерігалося в групах з високими дозами, з найбільшими відмінностями на 60-й (р = 0,002) і 90-й (р < 0,001) дні, коли група 3 показала кращі результати порівняно з групами 1 і 2, які не відрізнялись між собою. На пізніших етапах (105-й день) різниця між групами зменшилася, але пацієнти, які отримували вищі дози (група 3), все ж демонстрували найкращі результати. Проте через місяць різниці в якості життя між трьома групами не спостерігалося.
Тепловий графік (рис. 11) продемонстрував міжгрупові відмінності у динаміці якості життя за шкалою CQLS. Найбільша різниця в ефекті спостерігалася між групами 1 і 3 (d = 1,11) та групами 2 і 3 (d = 1,08) на 90-й день, що вказує на суттєве поліпшення якості життя в групі 3 порівняно з іншими. Виражені ефекти зберігались до 105-го дня, після чого спостерігалося їх зниження. Порівняння між групою 1 та групою 2 продемонструвало лише помірні відмінності на ранніх етапах (дні 7 і 30), тоді як решта точок показали низьку величину ефекту. Усі групи мали подібні стартові значення, що підтверджує однорідність вибірки на початку дослідження.
Результати дисперсійного аналізу повторних вимірювань показали статистично значущий ефект від фактора «Група» (р < 0,001), що підтверджує відмінності в якості життя між групами з різними дозами препарату (табл. 14).
Також було виявлено значущу динаміку з часом (р < 0,001), що свідчить про поліпшення якості життя в усіх групах пацієнтів протягом лікування. Водночас взаємодія між дозою і часом («Група*Час») була статистично значущою (р = 0,039), що вказує на те, що ефект змін якості життя залежить від дозування препарату і прогресує з часом, причому цей ефект виражений по-різному в різних групах (рис. 12).
Побічні ефекти. У групі 3 (прийом 60 мг/добу протягом 90 днів) спостерігався один випадок (3,33 %, для всієї вибірки — 1,11 %) головного болю на 8-й день лікування, який минув самостійно. Таким чином, цього випадку недостатньо для формування висновків про системність та характер побічних ефектів.
/34.jpg)
Отже, результати дослідження продемонстрували чіткий дозозалежний протитривожний ефект фабомотизолу. Пацієнти, які отримували вищі дози препарату (60 мг/добу), мали більш виражене та швидше зниження симптомів тривоги порівняно зі стандартною дозою 30 мг/добу. Ця різниця ставала помітною вже в перші тижні терапії: у групах з більшим дозуванням поліпшення спостерігалося протягом 7–14 днів від початку лікування. Надалі, протягом усього тримісячного курсу, рівень тривоги знижувався в усіх групах, але група з постійною високою дозою стабільно демонструвала кращі результати. Режим лікування з початковою високою дозою (60 мг/добу протягом першого місяця) та подальшим зниженням до 30 мг/добу забезпечував проміжний ефект — кращий, ніж у групі зі стандартною дозою, але дещо поступався ефективності постійної високої дози. Досягнуті терапевтичні поліпшення зберігалися навіть після завершення курсу лікування. Через місяць після відміни препарату рівень тривоги у пацієнтів залишався нижчим від початкового, хоча спостерігалося незначне підвищення симптомів порівняно з кінцем третього місяця терапії. Це свідчить про стійкість ефекту фабомотизолу: анксіолітична дія препарату не зникає одразу після припинення прийому, а утримується як мінімум протягом кількох тижнів після лікування при всіх досліджуваних режимах дозування.
Обговорення
Проведене дослідження продемонструвало дозозалежний анксіолітичний ефект фабомотизолу. Прийом препарату у збільшеному дозуванні супроводжувався більш вираженим зниженням симптомів тривоги, що узгоджується з попередніми даними щодо його фармакодинаміки. Фабомотизол, на відміну від бензодіазепінів, взаємодіє з -рецепторами, посилюючи чутливість ГАМК/бензодіазепінових рецепторів, та впливає на системи нейротрансмітерів, підвищуючи рівень нейротрофічних факторів (NGF, BDNF) у головному мозку [6]. Це може пояснювати виявлений дозозалежний характер його дії, оскільки більші дози, ймовірно, сильніше активують зазначені молекулярні мішені та шляхи, відповідальні за анксіолітичний ефект.
Селективні інгібітори зворотного захоплення серотоніну (СІЗЗС) зараз вважаються препаратами першої лінії терапії генералізованого тривожного розладу: в одному метааналізі дослідники зазначають, що більшість СІЗЗС та споріднених антидепресантів вірогідно перевершують плацебо за ефективністю. І хоча СІЗЗС зазвичай добре переносяться, все ж відома їхня властивість в низці випадків спричиняти побічні ефекти (зокрема, стійкі сексуальні дисфункції, нудоту тощо, а в деяких випадках і підвищення тривоги), що обмежує їх переносимість [4].
Бензодіазепіни, навпаки, забезпечують швидке зниження тривоги та традиційно широко застосовуються при тривожних розладах. Проте застосування бензодіазепінів пов’язане з ризиком седації, розвитком толерантності і лікарської залежності, особливо при тривалому прийомі. Через їхню швидку дію та небажання чекати настання ефекту від СІЗЗС або психотерапії бензодіазепіни призначаються частіше та на довші терміни, ніж це є доцільним [1].
На цьому тлі фабомотизол може мати важливу перевагу: у нашому дослідженні він продемонстрував анксіолітичний ефект без седативних побічних явищ та без ознак формування залежності, що відповідає попереднім дослідженням [11].
Практична значущість отриманих результатів полягає в тому, що вони надають додаткові докази щодо потенціалу застосування фабомотизолу як ефективного і безпечного засобу для лікування субклінічної та соматизованої тривоги.
Обмеження дослідження. Незважаючи на отримані позитивні результати та сильні сторони дизайну, це дослідження має певні обмеження. По-перше, вибірка була відносно невеликою та сформованою в межах одного центру, що може обмежувати статистичну потужність аналізу деяких показників і знижувати узагальненість висновків для ширшої популяції. По-друге, період спостереження був обмеженим трьома місяцями терапії та одним місяцем після її завершення; отже, залишається невідомим, чи зберігається терапевтичний ефект фабомотизолу у більш довгостроковій перспективі. Крім того, оцінка ефективності базувалася на суб’єктивних інструментах — опитувальниках і шкалах (зокрема, шкала тривоги Гамільтона та опитувальник 4DSQ). Хоча ці методики є валідизованими та широко застосовуються, їх використання пов’язане з певною часткою суб’єктивності оцінок та можливим упередженням респондентів. Ще одним методологічним обмеженням є відсутність плацебо-контрольної групи, через що складніше повністю виключити вплив ефекту очікування або спонтанного поліпшення стану. Нарешті, вибірка учасників складалася переважно з осіб із відносно помірними (субклінічними) проявами тривоги, тому результати не обов’язково екстраполюються на пацієнтів із тяжкими тривожними розладами чи іншими клінічними особливостями.
Перспективи подальших досліджень. Подальші дослідження щодо ефективності фабомотизолу можуть бути зосереджені на кількох ключових аспектах. По-перше, перспективним вбачається проведення багатоцентрових рандомізованих контрольованих досліджень з більшим розміром вибірки та тривалішим періодом спостереження, щоб оцінити довгострокову ефективність і безпеку препарату при тривожних розладах. По-друге, важливим може бути пряме порівняння фабомотизолу з іншими протитривожними препаратами, зокрема із СІЗЗС та бензодіазепінами, з урахуванням як клінічної ефективності, так і профілю побічних реакцій. Крім того, необхідно дослідити нейробіологічні механізми дії фабомотизолу, зокрема вплив на
-рецептори та нейротрофічні фактори (NGF, BDNF), що дозволить глибше зрозуміти молекулярні основи його анксіолітичної дії. Окремим напрямом є вивчення ефективності препарату у пацієнтів із різними типами тривожних розладів та коморбідними станами (наприклад, депресією чи соматоформними розладами). Також актуальною є оцінка економічної ефективності різних режимів дозування, що може мати важливе значення для оптимізації клінічної практики.
Висновки
Таким чином, проведене дослідження підтвердило ефективність фабомотизолу як анксіолітичного засобу та виявило чіткий дозозалежний характер його дії. Застосування дози 60 мг/добу приводило до швидшого і більш вираженого суб’єктивного зниження рівня тривоги, ніж стандартна доза 30 мг/добу: помітне поліпшення наставало вже на початку лікування і зберігалося протягом усього курсу. Найбільший сукупний терапевтичний ефект спостерігався при безперервному прийомі 60 мг/добу, тоді як схема з початковою високою дозою і подальшим переходом на підтримувальну дозу забезпечила результат, близький до максимального. Важливо, що досягнутий протитривожний ефект зберігався щонайменше протягом місяця після припинення терапії, а результати оцінювання тривоги на 105-й та 120-й дні значущо відрізнялись від результатів у 1-й день лікування, що підкреслює можливу здатність фабомотизолу забезпечувати не тільки швидке, але й стійке полегшення симптомів субклінічної тривоги. Отже, оптимізація дозування фабомотизолу (наприклад, застосування підвищеної початкової дози) може підвищити ефективність лікування субклінічної або соматизованої тривоги без погіршення переносимості, а подальше зменшення дози може забезпечити економічну ефективність за відсутності значущих змін клінічного ефекту від лікування. Водночас через невеликий об’єм вибірки необхідні подальші дослідження для підтвердження та розширення отриманих результатів.
Отримано/Received 11.02.2025
Рецензовано/Revised 10.03.2025
Прийнято до друку/Accepted 12.03.2025

/21.jpg)
/22.jpg)
/23.jpg)
/24.jpg)
/25.jpg)
/29.jpg)
/30.jpg)
/26.jpg)
/31.jpg)
/27.jpg)
/32.jpg)
/28.jpg)
/34.jpg)