Международный эндокринологический журнал Том 21, №2, 2025
Вернуться к номеру
Взаємозв’язок між показниками тиреоїдного статусу і рівнем пролактину в жінок репродуктивного віку з автоімунним тиреоїдитом і субклінічним гіпотиреозом
Авторы: Булдигіна Ю.В. (1), Белякова Ю.І. (1), Вацик М.М. (2), Терехова Г.М. (1)
(1) - ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ, Україна
(2) - Клініка «Мати і дитина», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
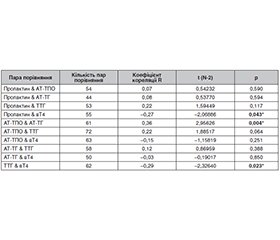
Актуальність. Відомо, що в пацієнтів з первинним гіпотиреозом підвищений рівень тиреотропін-рилізинг-гормону може спричинити зростання рівня пролактину (ПРЛ), що викликає галакторею-аменорею, однак дані щодо збільшення рівня ПРЛ у пацієнток із субклінічним гіпотиреозом є суперечливими. Це пояснюється невеликою кількістю досліджень, відмінностями в досліджуваних популяціях, розмірах вибірки та методології. У деяких дослідженнях виявлено, що гіперпролактинемія (ГПРЛ) є рідкісним розладом при субклінічному гіпотиреозі, але існують повідомлення щодо досить значної поширеності ГПРЛ при субклінічному гіпотиреозі — від 0 до 40 % пацієнтів. Мета нашого дослідження — оцінити рівень ПРЛ у жінок репродуктивного віку з автоімунним тиреоїдитом (АІТ) і встановити його залежність від показників тиреоїдного статусу. Матеріали та методи. Вивчали рівень ПРЛ у жінок репродуктивного віку з АІТ у стані еутиреозу і субклінічного гіпотиреозу. Результати. Встановлено, що рівень ПРЛ був вірогідно підвищений у жінок з АІТ порівняно з контрольною групою (18,2 ± 1,61 нг/мл проти 12,24 ± 1,64 нг/мл; p < 0,05). У результаті проведеного регресійного аналізу за Спірменом було виявлено вірогідний негативний кореляційний зв’язок між ПРЛ і вільним тироксином (Spearman R = –0,27; p = 0,043), що вказує на більш чутливий зв’язок між цими показниками, ніж між ПРЛ і тиреотропним гормоном (ТТГ). Аналіз вмісту ПРЛ залежно від рівнів ТТГ показав, що рівень ПРЛ вірогідно відрізняється в пацієнток з еутиреозом і субклінічним гіпотиреозом на тлі АІТ (16,48 ± 1,46 нг/мл проти 25,45 ± 5,29 нг/мл; p < 0,05). Не відзначається різниці в рівні ПРЛ у пацієнтів з АІТ і еутиреозом залежно від рівня ТТГ. Висновки. Рівень ПРЛ вірогідно підвищений у жінок з АІТ порівняно з контрольною групою (18,24 ± 1,61 нг/мл проти 12,24 ± 1,64 нг/мл; p < 0,05). Доведено, що в пацієнток з АІТ і субклінічним гіпотиреозом рівень ПРЛ є вірогідно вищим порівняно з показниками жінок з АІТ і еутиреозом (25,45 ± 5,29 нг/мл проти 16,48 ± 1,46 нг/мл; p < 0,05). Не встановлено вірогідних змін рівня ПРЛ у пацієнток з АІТ і еутиреозом при значеннях ТТГ вище за 2,5 мкМО/мл порівняно з контрольною групою (p > 0,05). Виявлено вірогідний негативний кореляційний зв’язок між ПРЛ і вільним тироксином (Spearman R = –0,27; p = 0,043), що вказує на більш чутливий зв’язок між цими показниками, ніж між ПРЛ і ТТГ.
Background. Patients with primary hypothyroidism often exhibit elevated thyrotropin-releasing hormone levels, potentially leading to hyperprolactinemia, which manifests as galactorrhea-amenorrhea. However, data on prolactin (PRL) content in subclinical hypothyroidism are inconsistent due to variations in study populations, sample sizes, and methodologies. In some studies, it has been found that hyperprolactinemia is a rare disorder in subclinical hypothyroidism, but there are reports of its fairly high prevalence in subclinical hypothyroidism — in 0–40 % of patients. This study purposed to assess PRL levels in reproductive-age women with autoimmune thyroiditis (AIT) and investigate correlations between PRL and thyroid hormone levels. Materials and methods. PRL level was analyzed in women with AIT in states of euthyroidism and subclinical hypothyroidism. Results. Findings revealed significantly elevated PRL in women with AIT compared to controls (18.24 ± 1.61 vs. 12.24 ± 1.64 ng/mL; p < 0.05). A Spearman regression analysis identified a significant negative correlation between PRL and free thyroxine (Spearman R = –0.27; p = 0.043), indicating a stronger association than between PRL and thyroid stimulating hormone (TSH). Analysis of PRL content depending on TSH levels showed that PRL significantly differed in patients with euthyroidism and subclinical hypothyroidism on the background of AIT (16.48 ± 1.46 vs. 25.45 ± 5.29 ng/ml; p < 0.05). No differences in PRL levels were observed among euthyroid patients with AIT based on TSH levels. Conclusions. PRL levels were significantly higher in women with AIT than in controls (18.24 ± 1.61 vs. 12.24 ± 1.64 ng/mL; p < 0.05). Women with subclinical hypothyroidism and AIT had significantly higher PRL levels than euthyroid women with AIT (25.45 ± 5.29 vs. 16.48 ± 1.46 ng/mL; p < 0.05). No statistically significant changes in prolactin levels were observed in patients with autoimmune thyroiditis and euthyroidism in TSH levels above 2.5 mIU/L compared to the control group (p > 0.05). A significant negative correlation between PRL and free T4 (Spearman R = –0.27; p = 0.043) indicates a more sensitive relationship compared to that between PRL and TSH.
автоімунний тиреоїдит; субклінічний гіпотиреоз; пролактин; тиреотропний гормон; антитіла до тиреоїдної пероксидази; антитіла до тиреоглобуліну; щитоподібна залоза
autoimmune thyroiditis; subclinical hypothyroidism; prolactin; thyroid stimulating hormone; thyroid peroxidase antibodies; thyroglobulin antibodies; thyroid gland
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Fachi MM, de Deus Bueno L, de Oliveira DC, da Silva LL, Bonetti AF. Efficacy and safety in the treatment of hyperprolactinemia: A systematic review and network meta-analysis. J Clin Pharm Ther. 2021 Dec;46(6):1549-1556. doi: 10.1111/jcpt.13460.
- Glezer A, Garmes HM, Kasuki L, Martins M, Elias PCL, Nogueira VDSN, et al. Hyperprolactinemia in women: diagnostic approach. Rev Bras Ginecol Obstet. 2024 Apr 25;46:e-FPS04. doi: 10.61622/rbgo/2024FPS04.
- Gierach M, Bruska-Sikorska M, Rojek M, Junik R. Hyper–prolactinemia and insulin resistance. Endokrynol Pol. 2022;73(6):959-967. doi: 10.5603/EP.a2022.0075.
- Benetti-Pinto CL, Nácul AP, Rosa E Silva ACJ, Maciel GAR, Nogueira VDSN, Elias PCL, et al. Hyperprolactinemia in women: treatment. Rev Bras Ginecol Obstet. 2024 Apr 25;46:e-FPS05. doi: 10.61622/rbgo/2024FPS05.
- Glezer A, Garmes HМ, Kasuki L, Martins M, Elias PCL, Nogueira VDSN, Rosa-E-Silva ACJS, et al. Diagnosis of hyperprolactinemia in women: A Position Statement from the Brazilian Federation of Gynecology and Obstetrics Associations (Febrasgo) and the Brazilian Society of Endocrinology and Metabolism (SBEM). Arch Endocrinol Metab. 2024 Apr 5;68:e230502. doi: 10.20945/2359-4292-2023-0502. PMID: 38578472.
- Fernandez-Gonzalez SM, Perez Vila MM, Prado-Carro AM. Precocious puberty in hypothyroidism: Mini-review of Van Wyk-Grumbach syndrome. J Endocr Soc. 2023 Nov 9;7(12):bvad135. doi: 10.1210/jendso/bvad135.
- Singhania P, Bhattarcharjee R, Chowdhury S. Van Wyk-Grumbach syndrome: a rare presentation of a common endocrine disorder. Endokrynol Pol. 2022;73(4):784-785. doi: 10.5603/EP.a2022.0044.
- Rathod S, Jajoo S, Shanoo A, Dande A, Kaplish D. Solving the Dilemma: Van Wyk-Grumbach Syndrome. Cureus. 2024 May 30;16(5):e61382. doi: 10.7759/cureus.61382.
- Sherwani P, Nandolia KK, Joshi K, Lourembam R. Imaging in Van Wyk Grumbach syndrome: An uncommon presentation of hypothyroidism. SA J Radiol. 2023 Mar 15;27(1):2572. doi: 10.4102/sajr.v27i1.2572.
- Edwards CR, Forsyth IA, Besser GM. Amenorrhoea, galactorrhoea, and primary hypothyroidism with high circulating levels of prolactin. Br Med J. 1971;3:462-464.
- Akhter N, Khanday A, Mir IN. Hypothyroidism and hyperprolactinemia as a cause of primary infertility: A Single Center Study. Int J Infertil Fetal Med. 2021;12(3):66-68. DOI: 10.5005/jp-journals-10016-1222.
- Borba V, Carrera-Bastos P, Zandman-Goddard G, Lucia A, Shoenfeld Y. Prolactin’s paradox: Friend, foe, or both in immune regulation? Autoimmun Rev. 2024 Nov;23(11):103643. doi: 10.1016/j.autrev.2024.103643.
- Karayazi Atıcı Ö, Govindrajan N, Lopetegui-González I, Shemanko CS. Prolactin: A hormone with diverse functions from mammary gland development to cancer metastasis. Semin Cell Dev Biol. 2021;114:159-170.
- Phillipps HR, Yip SH, Grattan DR. Patterns of prolactin secretion. Mol Cell Endocrinol. 2020;502:110679.
- Kikuyama S, Yazawa T, Abe S, Yamamoto K, Iwata T, Hoshi K, et al. Newt prolactin and its involvement in reproduction. Can J Physiol Pharmacol. 2000 Dec;78(12):984-93.
- Begon E, Bernard V. La prolactine et son récepteur : Des modèles animaux à la physiopathologie hypophysaire [Prolactin and its receptor: From animal models to pituitary pathophysiology]. Biol Aujourdhui. 2022;216(3–4):105-110. French. doi: 10.1051/jbio/2022019.
- Delini Devi R, Noor Azlin Azraini CSY, Najib Majdi Y, Wan Norlina WA, Hanisah AH. Correlation of serum prolactin and thyroid stimulating hormone concentration in infertile women: a systema–tic review and meta-analysis. Malays J Med Sci. 2024;31(1):14-32. https://doi.org/10.21315/mjms2024.31.1.2.
- Banu F. Correlation of serum prolactin and thyroid hormone in female infertility. J Nepalgunj Med College. 2019;17(2):32-34. doi: 10.3126/jngmc.v17i2.28758.
- Sahu JK, Ravikant M, Thakur AS. Hyperprolactinemia in patients with high TSH levels with both clinical and subclinical hypothyroidism. Panacea J Med Sci. 2022;12(1):134-137.
- Amberina AR, Jabeen А, Kumar С, Tagore R, Sankeerthi Ch, Ashalatha VL. Prevalence of hyperprolactinemia in hypothyroid patients. MedPulse International Journal of Biochemistry. December 2020;16(3):14-17. DOI: https://doi.org/10.26611/10021632.
- Ghoreshi ZA, Akbari H, Sharif-Zak M, Arefinia N, Abbasi-Jorjandi M, Asadikaram G. Recent findings on hyperprolactinemia and its pathological implications: a literature review. J Investig Med. 2022;70(7):1443-1451. doi: 10.1136/jim-2022-002351.
- Godines-Enriquez MS, Miranda-Velásquez S, Enríquez-Pérez MM, et al. Prevalence of thyroid autoimmunity in women with recurrent pregnancy loss. Medicina (Kaunas). 2021;57(2):96. doi: 10.3390/medicina57020096.
- Khizroeva J, Nalli C, Bitsadze V, et al. Infertility in women with systemic autoimmune diseases. Best Pract Res Clin Endocrinol Metab. 2019;33(6):101369. doi: 10.1016/j.beem.2019.101369.
- Laway BA, Sahu D, Bhat MH, Baba MS, Viswanath SA, Misgar RA, et al. Thyroid autoimmunity and subclinical hypothyroidism in prolactinoma: A Case Control Study. Indian J Endocrinol Metab. 2023 Jan-Feb;27(1):45-49. doi: 10.4103/ijem.ijem_425_21.
- Kumari DM, Ekka BR, Kumar S. Serum prolactin, thyroid stimulating hormone and thyroid hormones (FT3, FT4) concentrations in female patients with infertility: an institutional study. 2020;9(1).
- Venables A, Wong W, Way M, Homer HA. Thyroid autoimmunity and IVF/ICSI outcomes in euthyroid women: a systematic review and meta-analysis. Reprod Biol Endocrinol. 2020;18(1):120. doi: 10.1186/s12958- 020-00671-3.
- Kundu S, Rao SS, Singh K, Rao R. Study of thyroid profile and prolactin levels in female infertility patients: an institutional ana–lysis. J Sci Soc. 2021;48(1):13-16. doi: 10.4103/jss.JSS_79_20.
- Cengiz H, Demirci T, Varim C, Tamer A. The effect of Thyroid autoimmunity on dyslipidemia in patients with euthyroid hashimoto thyroiditis. Pak J Med Sci. 2021;37(5):1365-1370. doi: 10.12669/pjms.37.5.3883.
- Kim HJ, Park SJ, Park HK, Byun DW, Suh K, Yoo MH. Thyroid autoimmunity and metabolic syndrome: a nationwide popu–lation-based study. Eur J Endocrinol. 2021;185(5):707-715. doi: 10.1530/EJE-21-0634.
- Ewerman L, Landberg E, Hellberg S. Immunomodulating effects depend on prolactin levels in patients with hyperprolactinemia. Horm Metab Res. 2020;52(4):228-235. doi: 10.1055/a-1126-4272.
- Borba VV, Sharif K, Shoenfeld Y. Prolactin and the mosaic of autoimmunity, in mosaic of autoimmunity. Elsevier, 2019;435-447.
- Borba VV, Zandman-Goddard G, Shoenfeld Y. Prolactin and autoimmunity: the hormone as an inflammatory cytokine. Best Pract Res Clin Endocrinol Metab. 2019;33(6):101324. doi: 10.1016/j.beem.2019.101324.
- Borba VV, Zandman-Goddard G, Shoenfeld Y. Prolactin and Autoimmunity. Front Immunol. 2018;9:73. doi: 10.3389/fimmu.2018.00073.
- Önal M, Çalı Öztürk H. Investigating the association between hyperprolactinemia and thyroid autoimmunity in women. J Controv Obstetr Gynecol Ped. 2023;1(4):99-103.
- Alexander EK, Pearce EN, Brent GA, Brown RS, Chen H, Dosiou C, et al. 2017 Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum. Thyroid. 2017;27(3):315-389. doi: 10.1089/thy.2016.0457.