Международный эндокринологический журнал Том 21, №3, 2025
Вернуться к номеру
Активність аргіназо-NO-синтазної системи та зміни в системі NO в сироватці периферичної крові у вагітних із затримкою росту плода
Авторы: Лисий М.П.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
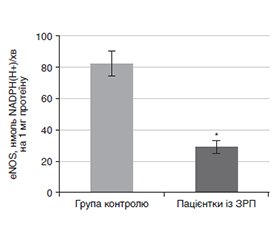
Актуальність. Оксидативний стрес, викликаний збільшенням активних форм кисню та/або недостатньою доступністю та активністю антиоксидантів, лежить в основі сучасної концепції патогенезу затримки росту плода (ЗРП). Оксидативний та нітрозативний стрес не існують окремо, а взаємодіють через утворення пероксинітриту. Отже, оцінка системи оксиду азоту (NO) в клінічних умовах може стати важливою для профілактики та лікування ЗРП. Мета: вивчити зміни активності ізоформ NO-синтази та аргінази в сироватці крові у вагітних із ЗРП та вплив цих змін на розвиток оксидативного та нітрозативного стресу. Матеріали та методи. У дослідження було включено результати обстеження 26 вагітних із встановленою ЗРП на етапі спостереження в ж/к, які увійшли до першої групи; до другої групи увійшло 18 умовно здорових вагітних з нормальними фетометричними показниками плода. Усім пацієнткам визначали NO-синтазну eнзиматичну активність сироватки крові при 37 °С у середовищі інкубації об’ємом 1,5 мл. Результати. Дані дослідження вказують на порушення балансу між метаболічними шляхами L-аргініну у пацієнток із ЗРП. Виявлено зміни активності ензимів аргіназо-NO-синтазної системи при даній патології, що насамперед виражаються в зростанні активності iNOS та зниженні активності аргінази. При дефіциті аргінази більше L-аргініну доступно для NO-синтази, що призводить до надмірного вироблення NО. У високих концентраціях NO є фактором ендогенної інтоксикації внаслідок його швидкої інактивації з утворенням токсичного пероксинітриту. Значна позитивна кореляція між сироватковим пероксинітритом і сумою нітритів та нітратів, які є стабільними метаболітами NO, вказує на посилену продукцію NO і, як наслідок, вищий рівень пероксинітриту у вагітних із ЗРП. Висновки. Продукція надмірної кількості нітрогену оксиду внаслідок перерозподілу активності NO-синтазної системи в бік Ca2+-незалежної індуцибельної ізоформи в умовах ішемії є причиною окиснювального та нітрозативного стресу, який відіграє ключову роль у патогенезі ЗРП.
Background. Oxidative stress caused by an increase in reactive oxygen species and/or insufficient availability and activity of antioxidants underlies the modern concept of the pathogenesis of fetal growth restriction (FGR). Oxidative and nitrosative stress do not exist separately, they interact through the formation of peroxynitrite. Therefore, assessment of the nitric oxide (NO) system in clinical settings may be important for the prevention and treatment of FGR. Purpose of the study was to investigate changes in the activity of NO synthase and arginase isoforms in serum of pregnant women with FGR and the impact of these changes on the development of oxidative and nitrosative stress. Materials and methods. The study included the results of the examination of 26 pregnant women with established FGR at the stage of observation in the hospital who made up the first group; the second group included 18 conditionally healthy pregnant women with normal fetal fetometric indicators. All patients had serum NO synthase enzyme activity determined at 37 °C in a 1.5 ml incubation medium. Results. The findings indicate an imbalance between the metabolic pathways of L-arginine in patients with FGR. Changes in the activity of the arginase-NO synthase system enzymes were found in this pathology, which is primarily expressed in an increase in iNOS activity and a decrease in arginase activity. With arginase deficiency, more L-arginine is available for NO synthase, which leads to excessive production of NO. At high concentrations, NO is a factor of endogenous intoxication due to its rapid inactivation with the formation of toxic peroxynitrite. A significant positive correlation between serum peroxynitrite and the sum of nitrites and nitrates, which are stable metabolites of NO, indicates increased NO production and, as a result, higher peroxynitrite levels in pregnant women with FGR. Conclusions. The production of excessive amounts of nitric oxide due to the redistribution of the activity of the NO synthase system towards the Ca²+-independent inducible isoform under conditions of ischemia is the cause of oxidative and nitrosative stress, which play a key role in the pathogenesis of FGR.
затримка росту плода; нітрогену оксид; NO-синтази; аргіназа; окиснювальний та нітрозативний стрес
fetal growth restriction; nitric oxide; NO synthases; arginase; oxidative and nitrosative stress
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Lees CC, Stampalija T, Baschat A, et al. Unterscheider J. ISUOG Practice Guidelines: diagnosis and management of small-for-gestational-age fetus and fetal growth restriction. Ultrasound Obstet Gynecol. 2020 Aug;56(2):298-312. doi: 10.1002/uog.22134. PMID: 32738107.
- Molina LCG, Odibo L, Zientara S, et al. Validation of Delphi procedure consensus criteria for defining fetal growth restriction. Ultrasound Obstet Gynecol. 2020 Jul;56(1):61-66. doi: 10.1002/uog.20854. Epub 2020 Jun 7. PMID: 31520557.
- Unterscheider J, Daly S, Geary MP, et al. Optimizing the definition of intrauterine growth restriction: the multicenter prospective PORTO Study. Am J Obstet Gynecol. 2013 Apr;208(4):290.e1-6. doi: 10.1016/j.ajog.2013.02.007. PMID: 23531326.
- Juan-Reyes SS, Gómez-Oliván LM, Juan-Reyes NS, et al. Women with preeclampsia exposed to air pollution during pregnancy: Relationship between oxidative stress and neonatal disease — Pilot study. Sci Total Environ. 2023;871:161858. doi: 10.1016/j.scitotenv.2023.161858.
- Puchkov V, Syusyuka VG, Deinichenko O, et al. The current state of the problem, clinical-pathogenetic approaches to the diagnosis and management tactics of fetal growth restriction. Women’s Reprod Health. 2024;5:74-83. https://doi.org/10.30841/2708-8731.5.2024.310397.
- Giouleka S, Tsakiridis I, Mamopoulos A, et al. Fetal Growth Restriction: A Comprehensive Review of Major Guidelines. Obstet Gynecol Surv. 2023 Nov;78(11):690-708. doi: 10.1097/OGX.0000000000001203. PMID: 38134339.
- Agarwal A, Makker K, Sharma R. Clinical relevance of oxidative stress in male factor infertility: an update. Am J Reprod Immunol. 2008 Jan;59(1):2-11. doi: 10.1111/j.1600-0897.2007.00559.x.
- Habib S, Ali A. Biochemistry of nitric oxide. Indian J Clin Biochem. 2011 Jan;26(1):3-17. doi: 10.1007/s12291-011-0108-4.
- Lancaster JR. Nitric oxide: a brief overview of chemical and physical properties relevant to therapeutic applications. Future Sci OA. 2015 Aug;1(1):FSO59. doi: 10.4155/fso.15.59.
- Kepka-Lenhart D, Mistry SK, Wu G, et al. Arginase I: a limiting factor for nitric oxide and polyamine synthesis by activa–ted macrophages? Am J Physiol Regul Integr Comp Physiol. 2000 Dec;279(6):R2237-42.
- Morris SM. Arginine metabolism: boundaries of our know–ledge. J Nutr. 2007 Jun;137(6 Suppl 2):1602S-160.
- Morgante G, Scolaro V, Tosti C, et al. Il trattamento con carnitina, acetilcarnitina, L-arginina e ginseng migliora la motilità spermatica e la salute sessuale negli uomini con astenozoospermia [Treatment with carnitine, acetyl carnitine, L-arginine and ginseng improves sperm motility and sexual health in men with asthenopermia]. Minerva Urol Nefrol. 2010 Sep;62(3):213-8. Italian. PMID: 20940690.9S.
- Khalil A, Gordijn SJ, Beune IM, et al. Essential variables for reporting research studies on fetal growth restriction: a Delphi consensus. Ultrasound Obstet Gynecol. 2019 May;53(5):609-614. doi: 10.1002/uog.19196. PMID: 30125411.
- King VJ, Bennet L, Stone PR, et al. Fetal growth restriction and stillbirth: Biomarkers for identifying at risk fetuses. Front Physiol. 2022 Aug 19;13:959750. doi: 10.3389/fphys.2022.959750. PMID: 36060697; PMCID: PMC9437293.
- Hrabarova E, Juranek I, Soltes L. Pro-oxidative effect of peroxynitrite regarding biological systems: a special focus on high-molar-mass hyaluronan degradation. Gen Physiol Biophys. 2011 Sep;30(3):223-38.
- Kamat JP. Peroxynitrite: a potent oxidizing and nitrating agent. Indian J Exp Biol. 2006 Jun;44(6):436-47.
- Ghimire K, Altmann HM, Straub AC, Isenberg JS. Nitric oxide: what’s new to NO? Am J Physiol Cell Physiol. 2017 Mar 1;312(3):254-262. doi: 10.1152/ajpcell.00315.2016. Epub 2016 Dec 14. PMID: 27974299; PMCID: PMC5401944.
- Caldwell RB, Toque HA, Narayanan SP, Caldwell RW. Arginase: an old enzyme with new tricks. Trends Pharmacol Sci. 2015 Jun;36(6):395-405. doi: 10.1016/j.tips.2015.03.006.
- Dronik IS, Yavorsky OG, Sklyarov YaO, Pshik RS. Chan–ges in some indicators of endothelial dysfunction in response to physical activity in people with hypertension. Acta medica Leopo–liensia. 2019;1(25):17-22. Ukrainian. https://doi.org/10.25040/aml2019.01.017.
- Markin LB, Popovych OI, Popovych AI. Activity of nitroso-oxidative processes in pregnant women with idiopathic arterial hypotension. Acta medica Leopoliensia. 2022;1-2(28):53-62. http://nbuv.gov.ua/UJRN/Lmch_2022_28_1-2_6.
- Caldwell RB, Toque HA, Narayanan SP, Caldwell RW. Arginase: an old enzyme with new tricks. Trends Pharmacol Sci. 2015 Jun;36(6):395-405. doi: 10.1016/j.tips.2015.03.006.
- Nüsken E, Appel S, Saschin L, et al. Intrauterine Growth Restriction: Need to Improve Diagnostic Accuracy and Evidence for a Key Role of Oxidative Stress in Neonatal and Long-Term Sequelae. Cells. 2024 Mar 13;13(6):501. doi: 10.3390/cells13060501. PMID: 38534344; PMCID: PMC10969486.
- Ashina M, Kido T, Kyono Y, et al. Correlation between Severity of Fetal Growth Restriction and Oxidative Stress in Severe Smallfor-Gestational-Age Infants. Int J Environ Res Public Health. 2021;18(20):10726. doi: 10.3390/ijerph182010726.