Международный эндокринологический журнал Том 21, №3, 2025
Вернуться к номеру
Визначення зв’язку між особливостями гормонального тла й ознаками жіночої сексуальної дисфункції у жінок з ендометріозом та без нього у прогнозі успішності гестації
Авторы: Семенюк Л.М. (1), Паньків В.І. (1), Козачук Є.С. (1), Крижановська О.І. (2)
(1) - ДНП «Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України», м. Київ, Україна
(2) - Інститут післядипломної освіти Національного медичного університету імені О.О. Богомольця,
м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
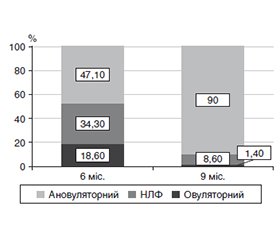
Актуальність. Подолання непліддя у жінок молодого віку визнано одним із найважливіших завдань медицини сьогодення. Серед чинників, які знижують фертильність жінок, залишається актуальним захворювання на ендометріоз. Значна поширеність захворювань зі спільними патогенетичними чинниками розвитку призвела до появи хвороб «похилого віку» у жінок репродуктивного віку. До таких належить, зокрема, жіноча сексуальна дисфункція (ЖСД). Зв’язок ЖСД і гормональних показників як прогностичних чинників репродуктивного здоров’я жінки сьогодні недостатньо досліджений. Мета: визначити зв’язок між особливостями гормонального тла й ознаками ЖСД у жінок з ендометріозом і без нього у прогнозі успішності майбутньої гестації. Матеріали та методи. Дизайн дослідження — проспективне когортне дослідження, яке охопило 130 жінок репродуктивного віку. Проведено розподіл жінок на 3 групи: основна група ІА (n = 70) — жінки з поєднанням жіночої сексуальної дисфункції та зовнішнього генітального ендометріозу; група порівняння ІВ (n = 30) — жінки з ЖСД без зовнішнього генітального ендометріозу; контрольна група ІІ (n = 30) — здорові репродуктивно активні жінки. Кінцевими точками дослідження були рівні гіпофізарних і яєчникових гормонів, проандрогенових стероїдів, овуляторність менструальних циклів. Указані показники досліджували до лікування і в контрольні терміни терапії — 3, 6, 9 міс. Наявність ЖСД визначали за допомогою опитувальника з підрахунком балів на онлайн-калькуляторі. Наявність ЖСД визначали при значенні індексу жіночої статевої функції (FSFI) менш ніж 26,55 бала. Лікування було спрямоване на відновлення коректної роботи яєчникового стероїдогенезу з використанням рослинної терапії. Статистичний аналіз виконували за допомогою спеціалізованого пакета статистичних програм SPSS 25.0 (StatSoft Inc., США). Результати. За показниками пептидних гормонів гіпофіза вірогідна нормалізація показників у групах порівняння відбувалася в термін із шостого по дев’ятий місяць терапії. За рівнем естрадіолу відзначалося його вірогідне зростання в обох групах порівняння протягом всього терміну спостереження. На дев’ятому місяці значення прогестерону у пацієнток із ЖСД і ендометріозом були вірогідно вищими, ніж без ендометріозу, р = 0,002. Незважаючи на проведене лікування, показники естрадіолу та прогестерону в групі ІА залишалися вірогідно нижчими порівняно з групою контролю впродовж всього періоду спостереження (р < 0,001). У пацієнток без ендометріозу (група ІВ) через 9 місяців лікування вдалося скоригувати лише значення естрогену, які були зіставними з групою контролю. Аналіз за допомогою критерію Данна з поправкою Бонферроні показав відсутність статистично значимої різниці між групами ІА і ІВ протягом всього курсу лікування (р > 0,05). При кореляційному аналізі встановлено, що у пацієнток із ЖСД і ендометріозом через 6 місяців лікування зміни концентрацій досліджуваних гормонів статистично значуще корелювали з поліпшенням балів за всіма категоріями опитувальника. У контрольний шестимісячний термін 20 (66,3 %) жінок не були готові до безпечного зачаття. У дев’ятимісячний контрольний термін до безпечного материнства у цій групі не були готові 16 (53,3 %) жінок. Висновки. Жінки із зовнішньо-внутрішнім ендометріозом і ЖСД та жінки з моноформою ЖСД мають різне патогенетичне тло у формуванні патології гестації. Терапія жінок із будь-якою формою ЖСД повинна мати персоніфікований характер. Оцінка доменів ЖСД дає можливість швидкої діагностики майбутніх гестаційних ризиків у жінок репродуктивного віку.
Background. Overcoming infertility in young women is recognized as one of the most important tasks of modern medicine. Among the factors that reduce female fertility, endometriosis remains relevant. The widespread prevalence of diseases with common pathogenetic factors has led to the emergence of diseases of “old age” in women of reproductive age. These include, in particular, female sexual dysfunction (FSD). The relationship between FSD and hormonal indicators as prognostic factors of female reproductive health has been little studied to date. The purpose was to determine the relationship between the characteristics of the hormonal background and signs of FSD in women with and without endometriosis in the prediction of the success of future gestation. Materials and methods. The study design is a prospective cohort study, which included 130 women of reproductive age. They were divided into 3 groups: group IA (n = 70) — a combination of female sexual dysfunction and extragenital endometriosis, the comparison group IB (n = 30) — female sexual dysfunction without extragenital endometriosis, the control group II (n = 30) — healthy reproductively active women. The end points of the study were levels of pituitary and ovarian hormones, proandrogenic steroids, ovulatory menstrual cycles. These indicators were studied before treatment and at the control periods of therapy — 3, 6, 9 months. The presence of FSD was determined using a questionnaire with scoring on an online calculator, when the female sexual function index was less than 26.55 points. The therapy was aimed at restoring the correct functioning of ovarian steroidogenesis using herbal therapy. Statistical analysis was performed using a specialized statistical software package SPSS 25.0 (StatSoft Inc., USA). Results. A significant normalization of pituitary peptide hormones in the comparison groups occurred in the period from the sixth to the ninth month of therapy. As for the estradiol level, its significant increase was noted in both comparison groups throughout the entire observation period. At the ninth month, the values of progesterone in patients with FSD and endometriosis were significantly higher in than those without it (p = 0.002). Despite the treatment, the estradiol and progesterone levels in the IA group remained significantly lower than in the control group throughout the entire observation period (p < 0.001). In patients without endometriosis (IB group), after 9 months of treatment, only estrogen values were successfully corrected, which were comparable to the control group. Analysis using Dunn’s test with Bonferroni correction showed no statistically significant difference between the IA and IV groups throughout the entire course of treatment (p > 0.05). Correlation analysis revealed that in patients with FSD and endometriosis after 6 months of treatment, changes in the studied hormones statistically significantly correlated with improvements in scores in all domains of the questionnaire. At the control period of 6 months, 20 (66.3 %) women were not ready for safe conception. In the 9-month control period, 16 (53.3 %) patients in this group were not ready for safe motherhood. Conclusions. Women with external-internal endometriosis and FSD and women with FSD alone have different pathogenetic background in the formation of gestational pathology. Therapy of patients with any form of FSD should be personalized. Assessment of FSD domains allows for rapid diagnosis of future gestational risks in women of reproductive age.
жіноча сексуальна дисфункція; ендометріоз; гормональний фон; овуляція; вагітність
female sexual dysfunction; endometriosis; hormones; ovulation; pregnancy
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Reed MA. Female Sexual Dysfunction. Clin Plast Surg. 2022 Oct;49(4):495-504. doi: 10.1016/j.cps.2022.06.009. Epub 2022 Aug 17. PMID: 36162944.
- Weinberger JM, Houman J, Caron AT, Anger J. Female Sexual Dysfunction: A Systematic Review of Outcomes Across Various Treatment Modalities. Sex Med Rev. 2019 Apr;7(2):223-250. doi: 10.1016/j.sxmr.2017.12.004. Epub 2018 Feb 3. PMID: 29402732.
- Kvaskoff M, Mu F, Terry KL, Harris HR, Poole EM, Farland L, Missmer SA. Endometriosis: a high-risk population for major chronic diseases? Hum Reprod Update. 2015 Jul-Aug;21(4):500-16. doi: 10.1093/humupd/dmv013.
- Kryzhanovska OI, Semeniuk LM. Physiological characteristics of reproductive-age patients with female sexual dysfunction and endometriosis (a comparison of clinical and laboratory parameters in different study groups). Zaporozhye Medical Journal [Internet]. 2024 May 31 [cited 2025 Apr. 23];26(3):210-6. Available from: https://zmj.zsmu.edu.ua/article/view/302358.
- Semeniuk LМ, Yuzvenko TY, Borodkin HO, Kryzhanovs–kaya OI. Determination of the risks of infertility in women with thyroid pathology and hypoandrogenic ovrian dysfunction. World of Medicine and Biology. 2020;3(73):111-115. doi: 10.26724/2079-8334-2020-3-73-111-115.
- Davis SR. Sexual Dysfunction in Women. N Engl J Med. 2024 Aug 22;391(8):736-745. doi: 10.1056/NEJMcp2313307. PMID: 39167808.
- Sha’ari N, Woon LS, Sidi H, Das S, Bousman CA, Mohamed Saini S. Beneficial effects of natural products on female sexual dysfunction: A systematic review and meta-analysis. Phytomedicine. 2021 Dec;93:153760. doi: 10.1016/j.phymed.2021.153760. Epub 2021 Sep 26. PMID: 34638031.
- Cieri-Hutcherson NE, Jaenecke A, Bahia A, Lucas D, Oluloro A, Stimmel L, Hutcherson TC. Systematic Review of l-Arginine for the Treatment of Hypoactive Sexual Desire Disorder and Related Conditions in Women. Pharmacy (Basel). 2021 Mar 27;9(2):71. doi: 10.3390/pharmacy9020071.
- Li Z, Wang Y, Xu Q, Ma J, Li X, Tian Y, Wen Y, Chen T. Ginseng and health outcomes: an umbrella review. Front. Pharmacol. 2023;14:1069268. doi: 10.3389/fphar.2023.1069268.
- Romashchenko O, Hryhorenko V, Melnykov S, Biloholovska V, Myronenko N, Dzhuraieva L. Sexual dysfunctions in women of different ages. Ukrainian Journal Men’s Health, Gender and Psychosomatic Medicine. 2022;1-2:14-5. doi: 10.37321/UJMH.2022.1-2-07.
- Pankiv V, Yuzvenko T. The relationships between variables of glycated hemoglobin and diabetes distress in patients with type 1 and type 2 diabetes mellitus. International Journal of Endocrino–logy (Ukraine). 2023;19(6):424-7. https://doi.org/10.22141/2224-0721.19.6.2023.1310.
- Deniz A, Kehribar DY. Evaluation of sexual functions in infertile women with polycystic ovary syndrome. Niger J Clin Pract. 2020;23(11):1548-54. doi: 10.4103/njcp.njcp_15_20.
- Krysiak R, Drosdzol-Cop A, Skrzypulec-Plinta V, Okopien B. Sexual function and depressive symptoms in young women with nonclassic congenital adrenal hyperplasia. J Sex Med. 2016;13(1):34-9. doi: 10.1007/s43032-021-00546-x.
- Naumova I, Castelo-Branco C, Casals G. Psychological issues and sexual function in women with different infertility causes: focus on polycystic ovary syndrome. Reprod Sci. 2021;28(10):2830-8. doi: 10.1007/s43032-021-00546-x.
- Sinha U, Sinharay K, Saha S, Longkumer TA, Baul SN, Pal SK. Thyroid disorders in polycystic ovarian syndrome subjects: A tertiary hospital based cross-sectional study from Eastern India. Indian J Endocrinol Metab. 2013;17:304-9. doi: 10.4103/2230-8210.109714.
- Youseflu S, Jahanian Sadatmahalleh S, Bahri Khomami M, Nasiri M. Influential factors on sexual function in infertile women with endometriosis: a path analysis. BMC Womens Health. 2020;20(1):92. doi: 10.1186/ s12905-020-00941-7.
- Lukic A, Di Properzio M, De Carlo S, Nobili F, Schimberni M, Bianchi P, Prestigiacomo C, Moscarini M, Caserta D. Quality of sex life in endometriosis patients with deep dyspareunia before and after laparoscopic treatment. Arch Gynecol Obstet. 2016 Mar;293(3):583-90. doi: 10.1007/s00404-015-3832-9. Epub 2015 Aug 6. PMID: 26246414.
- Macer ML, Taylor HS. Endometriosis and infertility: a review of the pathogenesis and treatment of endometriosis-associated infertility. Obstet Gynecol Clin North Am. 2012 Dec;39(4):535-49. doi: 10.1016/j. ogc.2012.10.002. PMID: 23182559; PMCID: PMC3538128.
- Clement A, Cornet DN, Alvarez S, Brami C, Clement P, Menezo Y. Endometriosis pathogenesis: role played by the oxidative stress due to MTHFR mutations. Fertil Steril. 2018;110:4. doi: https://doi.org/10.1016/j.fertnstert.2018.07.1102.
- Shum LK, Bedaiwy MA, Allaire C, Williams C, Noga H, Albert A, Lisonkova S, Yong PJ. Deep Dyspareunia and Sexual Quality of Life in Women With Endometriosis. Sex Med. 2018 Sep;6(3):224-233. doi: 10.1016/j.esxm.2018.04.006. Epub 2018 May 22. PMID: 29801714; PMCID: PMC6085224.