Международный неврологический журнал Том 21, №3, 2025
Вернуться к номеру
Порівняльний аналіз клініко-метаболічного профілю пацієнтів із цукровим діабетом 2-го типу залежно від наявності діабетичної полінейропатії
Авторы: Саєнко Я.А. (1, 2), Маньковський Б.М. (1)
(1) - ДУ «Інститут геронтології ім. Д.Ф. Чеботарьова НАМН України», м. Київ, Україна
(2) - ДУ «Центр кардіології та кардіохірургії МОЗ України», м. Київ, Україна
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
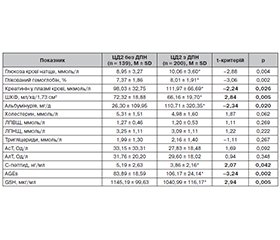
Актуальність. Цукровий діабет 2-го типу (ЦД2) — одне з найпоширеніших хронічних неінфекційних захворювань, серйозним ускладненням якого є діабетична полінейропатія (ДПН), що істотно знижує якість життя та сприяє розвитку інвалідності. Незважаючи на поширеність ДПН, чіткі критерії ранньої стратифікації ризику її розвитку залишаються невизначеними. Порівняльне дослідження клініко-метаболічного профілю пацієнтів з і без ДПН дозволяє краще зрозуміти патогенетичні механізми та фактори, пов’язані з цим ускладненням. Мета: провести порівняльний аналіз клініко-метаболічних показників у пацієнтів із ЦД2 залежно від наявності ДПН. Матеріали та методи. У дослідженні взяли участь 339 пацієнтів із ЦД2, яких розподілено на дві групи: з ДПН (n = 200) та без ДПН (n = 139). Оцінювали клінічні дані, лабораторні показники, ознаки ниркової та судинної дисфункції, рівень С-пептиду, AGEs, GSH, а також якість життя, сну та вегетативні симптоми. ДПН діагностували за стандартизованими критеріями, психоемоційний стан — за опитувальниками. Статистичний аналіз проводили із використанням t-тесту та -критерію. Результати. Пацієнти з ДПН мали вірогідно більшу тривалість ЦД2, гірший глікемічний контроль, знижену функцію нирок, вищі рівні AGEs і нижчий показник GSH. Виявлено більшу частоту ІХС, СН, ХХН та перенесеного ІМ у групі з ДПН. Також пацієнти з нейропатією мали нижчу оцінку свого здоров’я, гіршу якість сну та більшу вираженість вегетативних симптомів. Висновки. Наявність ДПН у пацієнтів із ЦД2 супроводжується несприятливим клініко-метаболічним профілем, мультисистемними ураженнями та зниженням якості життя. Отримані результати підтверджують доцільність ранньої стратифікації пацієнтів з ЦД2 за наявністю ДПН для розробки персоналізованих стратегій профілактики та лікування ускладнень.
Background. Type 2 diabetes mellitus (T2DM) is one of the most prevalent chronic non-communicable diseases, with diabetic polyneuropathy (DPN) being a serious complication that significantly impairs quality of life and contributes to disability. Despite the high prevalence of DPN, clear criteria for early risk stratification remain undefined. A comparative study of the clinical and metabolic profile of patients with and without DPN allows for a better understanding of the underlying mechanisms and associated factors. The purpose was to conduct a comparative analysis of clinical and metabolic parameters in patients with T2DM depending on the presence of DPN. Materials and methods. A total of 339 patients with T2DM were enrolled in the study and divided into two groups: with DPN (n = 200) and without DPN (n = 139). Clinical data, laboratory parameters, markers of renal and vascular dysfunction, C-peptide, AGEs, and GSH levels were assessed, along with quality of life, sleep, and autonomic symptoms. DPN was diagnosed using standardized criteria; psycho-emotional state was evaluated with validated questionnaires. Statistical analysis was performed using the t-test and 2-test. Results. Patients with DPN had significantly longer duration of diabetes, poorer glycemic control, impaired renal function, higher AGEs, and lower GSH levels. The DPN group also showed higher prevalence of coronary heart disease, heart failure, chronic kidney disease, and history of myocardial infarction. Additionally, these patients reported lower subjective health status, poorer sleep quality, and more pronounced autonomic symptoms. Conclusions. The presence of DPN in patients with T2DM is associated with an unfavorable clinical and metabolic profile, multisystem involvement, and reduced quality of life. These findings support the importance of early stratification of patients with T2DM by DPN status to develop personalized strategies for prevention and management of complications.
цукровий діабет 2-го типу; діабетична полінейропатія; клініко-метаболічний профіль пацієнтів; ускладнення
type 2 diabetes mellitus; diabetic polyneuropathy; clinical and metabolic profile of patients; complications