Журнал «Боль. Суставы. Позвоночник» Том 15, №2, 2025
Вернуться к номеру
Рівні розчинного ендогліну в сироватці крові хворих на системний червоний вовчак: зв’язок із перебігом захворювання та нейропсихічними проявами
Авторы: T.V. Stepaniuk, S.V. Shevchuk
Vinnytsia National Pirogov Memorial Medical University, Vinnytsia, Ukraine
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
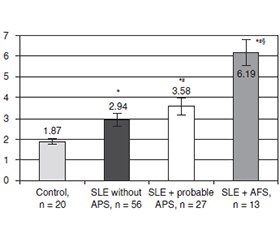
Актуальність. Ураження нервової системи при системному червоному вовчаку (СЧВ) є частими та різноманітними. Причини й механізми, що лежать в основі цих проявів, залишаються маловивченими. Останнім часом увагу дослідників привертає біомолекула ендоглін, яка асоціюється з окремими неврологічними й автоімунними захворюваннями, однак її роль у патогенезі нейропсихіатричного системного червоного вовчака (НПСЧВ) залишається невивченою. Мета: дослідити рівень розчинного ендогліну в сироватці крові пацієнтів із СЧВ, оцінити його зв’язок із демографічними показниками та запальною активністю та визначити діагностичну цінність як потенційного маркера НПСЧВ. Матеріали та методи. Обстежено 96 пацієнтів із СЧВ віком 19–55 років. Рівень розчинного ендогліну в сироватці крові досліджували за допомогою імуноферментного аналізу. Результати. В осіб із СЧВ уміст ендогліну був вірогідно вищим — на 90,4 % (р < 0,001) порівняно з контрольною групою. Зростання концентрації розчинного ендогліну асоціювалося з більш тривалим перебігом захворювання та вищою активністю за індексом SLEDAI-1, але не залежало від статі, віку пацієнтів чи застосування глюкокортикоїдів. Із підвищенням рівня розчинного ендогліну також зростала частка хворих з ураженням нервової системи. Аналіз показників психічного здоров’я в осіб із СЧВ залежно від квартильного розподілу рівнів ендогліну показав, що майже всі оцінювані параметри психічного стану вірогідно погіршувались від 1-го до 4-го квартиля. У групі Q4 частка пацієнтів із підтвердженими тривожними розладами, депресією та когнітивними порушеннями була статистично значуще більшою — у 2,4; 5,52 i 2,72 раза відповідно (p < 0,05) порівняно з групою Q1. Висока частота порушень пам’яті та сну спостерігалась в усіх квартильних групах без вірогідних міжгрупових відмінностей. Висновки. Рівень розчинного ендогліну в сироватці крові пацієнтів із СЧВ був на 90,4 % вищим, ніж у здорових осіб. Його збільшення асоціювалося з погіршенням показників психічного здоров’я — зі зростанням частоти виражених тривожних, депресивних і когнітивних розладів, безсоння.
Background. Nervous system involvement in systemic lupus erythematosus (SLE) is frequent and diverse. The causes and mechanisms underlying these manifestations remain poorly understood. Recently, the biomolecule endoglin, which is associated with certain neurological and autoimmune diseases, has garnered the attention of researchers; however, its role in the pathogenesis of neuropsychiatric systemic lupus erythematosus (NPSLE) remains unclear. The purpose was to investigate the serum level of soluble endoglin in patients with SLE, to evaluate its association with demographic parameters and inflammatory activity, and to determine its diagnostic value as a potential marker of NPSLE. Materials and methods. A total of 96 patients with SLE aged between 19 and 55 years were examined. The level of soluble endoglin in the blood serum was determined using an enzyme-linked immunosorbent assay. Results. In patients with SLE, the level of endoglin was significantly higher by 90.4 % (p < 0.001) compared to the control group. The increase in soluble endoglin concentration was associated with longer disease duration and higher disease activity, as measured by the SLEDAI-1 index. It was not related to sex factors, patient age, or glucocorticoid use. As the level of soluble endoglin increased, the proportion of patients with nervous system involvement also rose. Analysis of mental health indices in patients with SLE, depending on the quartile distribution of endoglin levels, showed that nearly all assessed mental health parameters significantly worsened from the 1st to the 4th quartile. In the Q4 group, the proportion of patients with confirmed anxiety disorders, depressive disorders, and cognitive dysfunction was statistically significantly higher by 2.4, 5.52, and 2.74 times, respectively (p < 0.05), compared to the Q1 group. A high frequency of memory and sleep disturbances was observed in all quartile groups, without statistically significant intergroup differences. Conclusion. The serum level of soluble endoglin in patients with SLE was 90.4 % higher than in healthy individuals. Elevated serum levels of soluble endoglin were associated with worsening mental health indices, specifically a significant increase in the proportion of individuals with pronounced anxiety, depressive and cognitive disorders, and insomnia.
системний червоний вовчак; нейропсихіатричні розлади; депресія; тривожність; когнітивні порушення; ендоглін
systemic lupus erythematosus; neuropsychiatric disorders; depression; anxiety; cognitive disorders; endoglin
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Seet D, Allameen NA, Tay SH, et al. Cognitive dysfunction in systemic lupus erythematosus: immunopathology, clinical manifestations, neuroimaging and management. Rheumatol Ther. 2021;8(2):651-679. doi: 10.1007/s40744-021-00312-0.
- Poshattiwar RS, Acharya S, Shukla S, et al. Neurological manifestations of connective tissue disorders. Cureus. 2023. doi: 10.7759/cureus.47108.
- Magro-Checa C, Zirkzee EJ, Beaart-van de Voor–de LJJ, et al. Value of multidisciplinary reassessment in attribution of neuropsychiatric events to systemic lupus erythematosus: prospective data from the Leiden NPSLE cohort. Rheumatology (Oxford). 2017;56(10):1676-1683. doi: 10.1093/rheumatology/kex019.
- Ota Y, Srinivasan A, Capizzano AA, et al. Central nervous system systemic lupus erythematosus: pathophy–siologic, clinical, and imaging features. RadioGraphics. 2022;42(1):212-232. doi: 10.1148/rg.210045.
- Kudsi M, Achmeh B, Khalayli N, et al. Central neurological manifestations in a sample of Syrian patients with systemic lupus erythematosus: cross sectional study. Ann Med Surg (Lond). 2024. doi: 10.1097/ms9.0000000000002361.
- Ren J, Zhao G, Sun X, et al. Identification of plasma biomarkers for distinguishing bipolar depression from major depressive disorder by iTRAQ-coupled LC-MS/MS and bioinformatics analysis. Psychoneuroendocrinology. 2017;86:17-24. doi: 10.1016/j.psyneuen.2017.09.005.
- Grignaschi S, Sbalchiero A, Spinozzi G, et al. Endoglin and systemic sclerosis: a PRISMA-driven systematic review. Front Med (Lausanne). 2022;9:964526. doi: 10.3389/fmed.2022.964526.
- Ma J, You Y. Endoglin promotes podocyte injury and apoptosis through the autophagy-lysosomal pathway in lupus nephritis. Int Immunopharmacol. 2025;150:114272. doi: 10.1016/j.intimp.2025.114272.
- Liu Y, Paauwe M, Nixon AB, et al. Endoglin targe–ting: lessons learned and questions that remain. Int J Mol Sci. 2020;22(1):147. doi: 10.3390/ijms22010147.
- Haarmann A, Zimmermann L, Bieber M, Silwedel C, Stoll G, Schuhmann MK. Regulation and release of vasoactive endoglin by brain endothelium in response to hypoxia/reoxygenation in stroke. Int J Mol Sci. 2022;23(13):7085. doi: 10.3390/ijms23137085.
- Margioula-Siarkou G, Margioula-Siarkou C, Pe–tousis S, et al. The role of endoglin and its soluble form in pathogenesis of preeclampsia. Mol Cell Biochem. 2021;477(2):479-491. doi: 10.1007/s11010-021-04294-z.
- Vicen M, Igreja Sá IC, Tripská K, et al. Membrane and soluble endoglin role in cardiovascular and metabolic disorders related to metabolic syndrome. Cell Mol Life Sci. 2020;78(6):2405-2418. doi: 10.1007/s00018-020-03701-w.
- Pinevich AA, Vartanyan NL, Terekhina LA, et al. Endoglin expression and surface renewal in mesenchymal stem cells and endothelial cells. Cell Tissue Biol. 2021;15(2):107-119. doi: 10.1134/s1990519x2102005x.
- Galaris G, Montagne K, Thalgott JH, et al. Thre–sholds of endoglin expression in endothelial cells explains vascular etiology in hereditary hemorrhagic telangiectasia type 1. Int J Mol Sci. 2021;22(16):8948. doi: 10.3390/ijms22168948.
- Jeng KS, Sheen IS, Lin SS, Leu CM, Chang CF. The role of endoglin in hepatocellular carcinoma. Int J Mol Sci. 2021;22(6):3208. doi: 10.3390/ijms22063208.
- Alsamman M, Sterzer V, Meurer SK, et al. Endoglin in human liver disease and murine models of liver fibrosis — a protective factor against liver fibrosis. Liver Int. 2018;38(5):858-867. doi: 10.1111/liv.13595.
- Aristorena M, Blanco FJ, de Las Casas-Engel M, et al. Expression of endoglin isoforms in the myeloid li–neage and their role during aging and macrophage polarization. J Cell Sci. 2014;127(Pt 12):2723-2735. doi: 10.1242/jcs.143644.
- Pérez-Gómez E, Eleno N, López-Novoa JM, et al. Characterization of murine S-endoglin isoform and its effects on tumor development. Oncogene. 2005;24(27):4450-4461. doi: 10.1038/sj.onc.1208644.
- Zhu Y, Sun Y, Xie L, et al. Hypoxic induction of endoglin via mitogen-activated protein kinases in mouse brain microvascular endothelial cells. Stroke. 2003;34(10):2483-2488. doi: 10.1161/01.STR.0000088644.60368.ED.
- Li C, Guo B, Ding S, et al. TNF alpha down-regulates CD105 expression in vascular endothelial cells: a comparative study with TGF beta 1. Anticancer Res. 2003;23(2B):1189-1196.
- Varejckova M, Gallardo-Vara E, Vicen M, et al. Soluble endoglin modulates the pro-inflammatory mediators NF-κB and IL-6 in cultured human endothelial cells. Life Sci. 2017;175:52-60. doi: 10.1016/j.lfs.2017.03.014.
- Armaly Z, Jadaon JE, Jabbour A, et al. Preeclampsia: novel mechanisms and potential therapeutic approaches. Front Physiol. 2018;9:973. doi: 10.3389/fphys.2018.00973.
- Bassyouni I, El-Shazly R, Azkalany G, et al. Clinical significance of soluble-endoglin levels in systemic lupus erythematosus: possible association with anti-phospholipid syndrome. Lupus. 2012;21(14):1565-1570. doi: 10.1177/0961203312460115.
- Aringer M. EULAR/ACR classification criteria for SLE. Semin Arthritis Rheum. 2019;49(3):10. doi: 10.1016/j.semarthrit.2019.09.009.
- Lai NS, Lu MC, Chang HH, et al. A comparison of the correlation of systemic lupus erythematosus disease activity index 2000 (SLEDAI-2K) and systemic lupus erythematosus disease activity score (SLE-DAS) with health-related quality of life. J Clin Med. 2021;10(10):2137. doi: 10.3390/jcm10102137.
- Lacerda MI, de Jesús GR, dos Santos FC, et al. The SLICC/ACR damage index (SDI) may predict adverse obstetric events in patients with systemic lupus erythematosus. Lupus. 2021;30(12):1966-1972. doi: 10.1177/09612033211045061.
- Miyakis S, Lockshin MD, Atsumi T, et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). J Thromb Haemost. 2006;4(2):295-306. doi: 10.1111/j.1538-7836.2006.01753.x.
- Dunstan DA, Scott N. Clarification of the cut-off score for Zung’s self-rating depression scale. BMC Psychiatry. 2019;19(1):177. doi: 10.1186/s12888-019-2161-0.
- Zsido AN, Teleki SA, Csokasi K, et al. Development of the short version of the Spielberger State-Trait Anxiety Inventory. Psychiatry Res. 2020;291:113223. doi: 10.1016/j.psychres.2020.113223.
- Khan G, Mirza N, Waheed W. Developing guidelines for the translation and cultural adaptation of the Montreal Cognitive Assessment: scoping review and qualitative synthesis. BJPsych Open. 2022;8(1). doi: 10.1192/bjo.2021.1067.
- Wienke J, Pachman LM, Morgan GA, et al. Endothelial and inflammation biomarker profiles at diagnosis reflecting clinical heterogeneity and serving as a prognostic tool for treatment response in two independent cohorts of patients with juvenile dermatomyositis. Arthritis Rheumatol. 2020;72(7):1214-1226. doi: 10.1002/art.41236.
- Hofstedt O, Wahlin B, Södergren A. Associations between serological biomarkers and subclinical atherosclerosis in patients with rheumatoid arthritis after 11 years of follow-up. Clin Exp Rheumatol. 2024;42(5):967-973. doi: 10.55563/clinexprheumatol/70qiy8.
- Juraskova B, Andrys C, Holmerova I, et al. Transfor–ming growth factor beta and soluble endoglin in the healthy senior and in Alzheimer’s disease patients. J Nutr Health –Aging. 2010;14(9):758-761. doi: 10.1007/s12603-010-0325-1.
- Emeksiz HC, Bideci A, Damar Ç, et al. Soluble endoglin level increase occurs prior to development of subclinical structural vascular alterations in diabetic adolescents. J Clin Res Pediatr Endocrinol. 2016;8(3):313-320. doi: 10.4274/jcrpe.2906.
- Trebatický B, Žitňanová I, Dvořáková M, et al. Role of oxidative stress, adiponectin and endoglin in the pathophysiology of erectile dysfunction in diabetic and non-diabetic men. Physiol Res. 2019;68(4):623-631. doi: 10.33549/physiolres.934129.
- Gerrits T, Brouwer IJ, Dijkstra KL, et al. Endoglin is an important mediator in the final common pathway of chronic kidney disease to end-stage renal disease. Int J Mol Sci. 2022;24(1):646. doi: 10.3390/ijms24010646.
- Chen H, Wang Y, Sun B, et al. Negative correlation between endoglin levels and coronary atherosclerosis. Li–pids Health Dis. 2021;20(1):127. doi: 10.1186/s12944-021-01545-2.
- Mohsenin V, Urbano F. Circulating antiangiogenic –proteins in obstructive sleep apnea and hypertension. Respir Med. 2011;105(5):801-807. doi: 10.1016/j.rmed.2011.01.001.
- Yoon Y, Voloudakis G, Doran N, et al. PS1 FAD mutants decrease ephrinB2-regulated angiogenic functions, ischemia-induced brain neovascularization and neuronal survival. Mol Psychiatry. 2021;26(6):1996-2012. doi: 10.1038/s41380-020-0812-7.
- Haarmann A, Vollmuth C, Kollikowski AM, et al. Vasoactive soluble endoglin: a novel biomarker indicative of reperfusion after cerebral large-vessel occlusion. Cells. 2023;12(2):288. doi: 10.3390/cells12020288.
- Dietmann A, Lackner P, Fischer M, et al. Soluble endoglin and transforming growth factor-β1 and the deve–lopment of vasospasm after spontaneous subarachnoid hemorrhage: a pilot study. Cerebrovasc Dis. 2012;33(1):16-22. doi: 10.1159/000331925.