Журнал «Травма» Том 26, №3, 2025
Вернуться к номеру
Динаміка ультраструктурних змін сідничного нерва після його тракційної травми в експерименті
Авторы: M.V. Vorodi (1, 2), V.V. Vaslovych (1), T.I. Petriv (1), V.R. Vorobyov (1), O.M. Velychko (1), T.A. Malysheva (1), V.I. Tsymbaliuk (3)
(1) - State Institution “Romodanov Neurosurgery Institute of the National Academy of Medical Sciences
of Ukraine”, Kyiv, Ukraine
(2) - Bogomolets National Medical University, Kyiv, Ukraine
(3) - National Academy of Medical Science of Ukraine, Kyiv, Ukraine
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
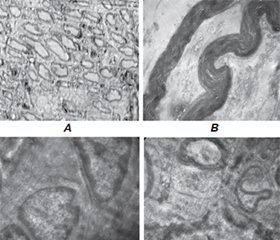
Актуальність. Необхідність удосконалення підходів до діагностики та лікування постраждалих при бойових травмах є надзвичайно актуальною з огляду на значну кількість пацієнтів із тяжкими поліструктурними ушкодженнями, у тому числі периферичних нервів. Подібні травми часто супроводжуються високим рівнем ускладнень та інвалідності, що потребує створення нових й оптимізації існуючих методів надання медичної допомоги. Тракційні пошкодження периферичних нервів, викликані розтягненням, часто призводять до незадовільних функціональних результатів. Вивчення функціональних і структурних змін, що впливають на ймовірність та якість відновлення після таких травм, є надзвичайно важливим, оскільки розуміння ультраструктурних аспектiв дозволить розробити підходи до регенеративної терапії. Мета: порівняльна характеристика ультраструктурних змін сідничного нерва після його тракційного ушкодження в експерименті. Матеріали та методи. Після загальної анестезії в асептичних умовах проводили хірургічний доступ до сідничного нерва білих безпородних самців щурів (250 ± 50 г) і моделювали його тракційну травму за допомогою спеціально розробленого пристрою. Тварини були розподілені на групи залежно від терміну спостереження: 15 (n = 10), 30 (n = 10), 60 діб після травми (n = 10) та групу порівняння (псевдооперовані, n = 6). В усіх них після моделювання тракційної травми виділяли сідничний нерв для подальшого дослідження; щурів виводили з експерименту шляхом введення летальної дози анестетика. Тканину сідничного нерва досліджували на ультраструктурному рівні за допомогою електронної мікроскопії для оцінки морфофункціональних компенсаторно-пристосувальних реакцій. Результати. На 15-ту добу щільність нервових волокон у проксимальному сегменті сідничного нерва становила 177 (168; 194), а в дистальному — 175 (152; 203), що було статистично вірогідно нижче порівняно з групою псевдооперованих тварин (287 (276; 292)) — в 1,6 раза для обох ділянок. Відношення мієлінової оболонки до осьового циліндра дорівнювало 0,389 (0,345; 0,515) у проксимальному сегменті та 0,435 (0,360; 0,494) — у дистальному, що статистично вірогідно перевищувало значення групи псевдооперованих (0,292 (0,262; 0,320)) в 1,3 та 1,5 раза відповідно. На 30-ту добу дослідження в проксимальному відділі сідничного нерва тварин щільність нервових волокон становила 258 (248; 274), а в дистальному — 243 (236; 269) і була статистично незначущою порівняно з групою псевдооперованих. На 60-ту добу зафіксовано статистично значуще зниження відношення мієлінової оболонки до осьового циліндра: у проксимальному сегменті — до 0,257 (0,190; 0,335) та в дистальному — до 0,292 (0,250; 0,356), що в 1,5 раза нижче, ніж на 15-ту добу для обох ділянок. Висновки. При тракційній травмі нерва спостерігаються ультраструктурні зміни в проксимальному та дистальному відділах сідничного нерва, які залежать від часу після ушкодження. На ранніх стадіях спостерігається набухання клітин, зменшення міжклітинних просторів, аксоплазматичне освітлення мієлінізованих нервових волокон, втрата частини цитоскелета (мікротрубочок і нейрофіламентів). Морфогенез травми периферичних нервів потребує подальших досліджень для розробки ефективних стратегій лікування, включаючи регенеративну терапію.
Background. The need to improve approaches to the diagnosis and treatment of combat trauma victims is extremely urgent, given the significant number of patients with severe polystructural injuries, including peripheral nerve trauma. Such injuries are often accompanied by a high level of complications and disability, which requires the creation of new and optimization of existing methods of providing medical care. Traction injuries of the peripheral nerve caused by stretching often lead to unsatisfactory functional outcomes. Studying the functional and structural changes that affect the likelihood and quality of recovery after such injuries is of utmost importance, because valid model of nerve traction injury will allow studying the effect of regenerative therapy. The purpose was to compare ultrastructural cell characteristics and changes in sciatic nerve traction injury in an experiment. Materials and methods. After general anesthesia in aseptic conditions, surgical approach to sciatic nerve in white outbreed male rats (250 ± 50 g) and sciatic nerve stretching was performed using a specially designed device. The animals were divided into groups depending on the observation period: 15 days after injury (n = 10), 30 days (n = 10), 60 days (n = 10) and the control group (sham-operated) (n = 6). All of them underwent a surgical procedure to isolate the sciatic nerve after causing traction injury for its further analysis and were removed from experiment by injection of lethal dose of anesthetics. The sciatic nerve tissue was examined at the ultrastructural level using electron microscopy to assess morpho-functional compensatory-adaptive reactions. Results. On day 15, the nerve fiber density in the proximal segment of the sciatic nerve was 177 (168; 194), and in the distal segment — 175 (152; 203), which was statistically significantly lower compared to the control group (287 (276; 292)), by 1.6 times for both segments. The myelin sheath to axial cylinder ratio was 0.389 (0.345; 0.515) in the proximal segment and 0.435 (0.360; 0.494) in the distal segment, which was statistically significantly higher than the value of the control group (0.292 (0.262; 0.320)), by 1.3 and 1.5 times, respectively. On the 30th day, in the proximal part of the sciatic nerve of the animals, the nerve fiber density was 258 (248; 274), and in the distal part — 243 (236; 269) that was statistically insignificant compared to the control group. On day 60 of the study, a statistically significant decrease in the myelin sheath to axial cylinder ratio was recorded in the proximal segment to 0.257 (0.190; 0.335) and in the distal one — to 0.292 (0.250; 0.356), which is 1.5 times lower than on day 15 for both segments. Conclusions. In case of traction nerve injury, structural changes and disruption of order in the proximal and distal segments of the sciatic nerve are observed, which depend on the time after injury. In the early stages, there were cell swelling, reduction of intercellular spaces, axoplasmic lightening of myelinated axons, and loss of part of the cytoskeleton (microtubules and neurofilaments). The morphogenesis of peripheral nerve injury requires further research to develop effective treatment strategies, including regenerative therapy.
травма сідничного нерва; травма розтягнення (тракційна травма); ультраструктурний аналіз; щільність аксонів; осьовий циліндр
sciatic nerve injury; stretching injury (traction injury); ultrastructural analysis; axon density; axial cylinder