Вступ
Міжнародна асоціація з вивчення болю (IASP) визначає біль як неприємне сенсорне та емоційне переживання, пов’язане з фактичним або потенційним пошкодженням тканин. Сприйняття больових відчуттів залежить від контексту подразника, попереднього досвіду, поточного психологічного та фізичного стану. Пацієнти бояться болю, тому що він завдає значних страждань, а клініцисти можуть не справлятися з ним належним чином, бо не завжди розуміють його походження [1]. Однак цей симптом не можна ігнорувати, оскільки він порушує поведінкову та когнітивну діяльність, породжує тривогу та/або депресію [2, 3]. Гострий біль є однією з найбільш поширених причин звернення до лікаря у всіх частинах світу [4] і часто асоціюється з такими ситуаціями, як невідкладна та планова хірургія, тяжкі захворювання, травми, пологи, опіки, стихійні лиха, війна та тортури [5].
Заходи з полегшення болю ускладнюються політичними конфліктами, соціально-економічними аспектами, обмеженими запасами аналгетиків у багатьох місцях. Хоча низка розвинених країн запровадили створення експертних груп з лікування та контролю гострого болю, ці дії все ще є недостатніми у багатьох медичних установах [5].
Гострий біль, що триває понад 3 місяці, може набути хронічного характеру зі складним патофізіологічним механізмом формування [5]. Американське товариство лікарів інтервенційного болю (ASIPP) визначило хронічний біль як «біль, який зберігається 6 місяців після травматичного пошкодження тканини, м’яза, нерва і виходить за межі звичайного перебігу гострого захворювання або часу, необхідного для загоєння травми; який пов’язаний з хронічними патологічними процесами, що викликають безперервний або періодичний больовий синдром протягом місяців або років, який може тривати при наявності або відсутності очевидної патології; може не піддаватися рутинним методам контролю; і зцілення може ніколи не відбутися» [5, 6].
Численні клінічні стани, що характеризуються хронічним болем, зазвичай описуються на основі локалізації (наприклад, спина, голова, внутрішні органи) та типу травми (наприклад, нейропатична, артритна, ракова, міофасціальна, діабетична). Зокрема, нейропатичний біль розвивається в результаті ураження або захворювання периферичних та центральних відділів соматосенсорної нервової системи. Він характеризується спонтанним болем і викликаними больовими реакціями після дії шкідливих або нешкідливих подразників [7]. Інша група синдромів класифікується як синдроми центральної чутливості, або функціональні соматичні синдроми, або медичні нез’ясовані клінічні стани (фіброміалгія, синдром подразненого кишечника, синдром хронічної втоми, хронічний біль у спині). Вони часто поєднуються і породжують больові відчуття різної локалізації [8]. Це свідчить про те, що модулююча інформація, пов’язана з болем, може стати причиною виникнення та/або підтримки хронічного больового синдрому. Найкращим прикладом є фіброміалгія, при якій важко визначити тип пошкодженої тканини, а ступінь м’язово-скелетного болю, втоми та змін сну сильно відрізняється у пацієнтів і може бути замаскований іншими симптомами [5, 9].
Механізм виникнення нейропатичного болю
Трансдукція, передача, модуляція і сприйняття — основні елементи, що беруть участь у механізмах фізіології болю. Нейропатичний біль унікальний тим, що він оминає перший етап перетворення подразника на електричний імпульс, оскільки виникає при прямому пошкодженні нерва. Ноцицептивний і невропатичний біль утворюють «континуум болю», механізми якого ще до кінця не вивчені. Оскільки больові відчуття стосуються всієї нервової системи, важливо розуміти окремі частини та весь процес їх появи [7].
Низку фізіологічних механізмів можуть викликати травми, що призводять до ноцицептивних реакцій і врешті-решт до болю [11]. У відповідь на подразники потенціали дії передаються сенсорними волокнами до тіл відповідних первинних сенсорних нейронів у гангліях дорсальних корінців [5, 10].
Найважливішими периферичними нервовими волокнами є первинні сенсорні аферентні волокна А і С, які передають больові сигнали від механічних, теплових і хімічних подразників та досягають спинномозкових нейронів за допомогою синаптичної передачі в дорсальному розі спинного мозку. Нейромедіатори (глутамат, речовина Р тощо) модулюють постсинаптичні реакції та індукують подальшу передачу до супраспінальних ділянок (таламус, передня поясна кора, острівцева кора та соматосенсорна кора) через висхідні шляхи [12]. Розширена або інтенсивна активність нейронів дорсального рогу, що викликана повторюваною або тривалою стимуляцією, може посилити реакцію нейронів на будь-які подразнення [5, 10, 11].
При периферичній сенсибілізації підвищена збудливість нейронів виникає там, де формується больовий імпульс, тоді як при центральній сенсибілізації вона виникає в нейронах спинного мозку. Повторна стимуляція певних спинномозкових нейронів змушує їх спрацьовувати частіше, тим самим посилюючи біль і збільшуючи його тривалість. Больові сигнали надходять не тільки від місця травми, а й від нейронних повідомлень або імпульсів. Пошкодження нервів може призвести до нейропатичного болю, який триває довше, ніж сама травма, значно перевищує «нормальну» реакцію на подразник, може поширюватися на інші частини тіла. Цей процес відіграє головну роль у розвитку хронічного болю [5].
Механізм посилення болю в спинному мозку пов’язаний з ноцицептивними нейронами дорсального рогу та немієліновими С-волокнами. Рецептори N-methyl-D-аспартату (NMDA) нейронів другого порядку активуються під час передачі подразників С-волокном. Це індукує вхід кальцію в нейрони дорсального рогу [11], що активує синтазу оксиду азоту (NO) і збільшує синтез NO. Оксид азоту може впливати на ноцицепторні термінали і посилювати вивільнення сенсорних нейропептидів (особливо речовини Р) з пресинаптичних нейронів, що сприяє розвитку гіпералгезії і підтримці центральної сенсибілізації [5, 10, 11].
Відкриття того, що активація глії відіграє вирішальну роль у модулюванні функцій нейронів і впливає на спінальну обробку ноцицептивних сигналів, дозволило по-новому поглянути на механізми, які лежать в основі центральної сенсибілізації та беруть участь у полегшенні хронічного болю. Активація спинномозкової глії є основним фактором розвитку та підтримки алодинії та гіпералгезії на різних моделях хронічного болю, зокрема нейропатичного болю та болю, пов’язаного з периферичним запаленням, а також бере участь у деяких формах вісцеральної гіпералгезії. Розробка специфічних інгібіторів, які будуть модулювати медіатори, націлені на нейрони і гліальні клітини, може привести до появи нових методів лікування болю [13].
НПЗП у рамках лікування хронічного болю
Нещодавні популяційні опитування, проведені в основних європейських країнах, показали, що хронічний біль був зареєстрований у 25–35 % дорослих. При цьому 79 % пацієнтів страждають від хронічного болю понад 4 роки. Біль у попереку та шиї є провідною глобальною причиною інвалідності в Європі. Наявність нейропатичного болю пов’язана з підвищеним тягарем захворювання, що негативно впливає на якість життя пацієнтів та підвищує медичні витрати [10]. Таким чином, швидко зростає попит на безпечне та ефективне лікування болю.
НПЗП — лікарські засоби, що найчастіше застосовують пацієнти як за призначенням лікаря, так і для самолікування [14].
НПЗП призначають для полегшення болю (аналгезивна дія), зменшення запалення (протизапальна дія), зниження температури тіла при лихоманці (жарознижувальна дія). Загальний механізм дії препаратів групи НПЗП пов’язаний з блокадою ферменту циклооксигенази (ЦОГ), внаслідок чого знижується вироблення простагландинів — групи метаболітів арахідонової кислоти, які відіграють ключову роль у розвитку запалення та больового відчуття. В організмі ЦОГ існує у вигляді двох ізоформ — ЦОГ-1 та ЦОГ-2. ЦОГ-1 в основному міститься в нирках, шлунку та тромбоцитах. Вона є важливим ферментом, який каталізує біосинтез ейкозаноїдів, що сприяють агрегації тромбоцитів та вазоконстрикції. Блокада цієї ізоформи пов’язана з появою знеболювального та протизапального ефекту переважно на ранніх стадіях запального процесу [15]. ЦОГ-2 швидко активується при запаленні, але водночас підтримує вироблення простагландинів, зокрема PGI2, запобігаючи тромбозу [14, 16, 17].
Баланс між ізоформами ЦОГ є важливим для профілактики утворення тромбів [19, 20]. До того ж простагландини (PGE2 і PGI2) підтримують нирковий кровообіг та фільтрацію, особливо при низькому об’ємі циркулюючої крові [21]. Вони, зокрема, стимулюють виділення калію та активують ренін-ангіотензин-альдостеронову систему [21]. Зменшення кількості простагландинів і ЦОГ-2 може спричинити затримку натрію, набряки та підвищення артеріального тиску, а також знижувати ефективність гіпотензивних препаратів [18, 23, 24].
Залежно від переважного впливу на ЦОГ-1 та ЦОГ-2 сучасні НПЗП поділяються на неселективні (блокують обидві ізоформи ферменту), селективні (блокують переважно ЦОГ-2 та меншою мірою впливають на ЦОГ-1) та високоселективні (інгібують ЦОГ-2 та практично не діють на ЦОГ-1) [14].
На жаль, в Україні відсутня єдина концепція в управлінні хронічним болем і його лікуванні лікарями первинної та вторинної ланки. Це пов’язано з кількома дуже важливими факторами, а саме:
— орієнтація на закордонні «опіоїдні» протоколи лікування хронічного болю;
— раннє застосування опіоїдів у лікуванні хронічного болю;
— опіоїдна залежність та відсутність альтернативного лікування;
— застаріла класифікація хронічного болю (відсутність ноципластичного болю);
— неповне розуміння патофізіології хронічного болю (відсутність або неповне розуміння сенситивізації та нейропластичності) [25].
Лікування легкого та помірного болю (зокрема, ноцицептивного) традиційно ґрунтується на застосуванні нестероїдних протизапальних препаратів та синтетичного неопіоїдного аналгетика парацетамолу (ацетамінофену) [25]. Ці засоби ефективні, рекомендовані та широко призначаються. Однак вони можуть викликати небажані ефекти. Шлунково-кишковий тракт (ШКТ) найчастіше страждає від побічних реакцій, пов’язаних з НПЗП. Ці явища представлені широким спектром ускладнень, зокрема гастродуоденальними субепітеліальними крововиливами, ерозіями та виразками. Попри те, що ці побічні ефекти не є поширеними, постійне збільшення частоти застосування НПЗП протягом останніх трьох десятиліть призвело до значного зростання захворюваності та смертності, пов’язаних зі шлунково-кишковою токсичністю НПЗП [17]. Для зменшення побічних ефектів і ускладнень з боку шлунково-кишкового тракту були розроблені селективні інгібітори ЦОГ-2, але широкомасштабні дослідження висвітлили ще більш серйозний потенційний ефект таких засобів — серцево-судинні ускладнення. Європейське агентство з лікарських засобів (EMA) та Управління з санітарного нагляду за якістю харчових продуктів і медикаментів (FDA) США випустили рекомендації щодо застережень та обмежень при призначенні інгібіторів ЦОГ-2, особливо для пацієнтів з підвищеним серцево-судинним ризиком та при необхідності тривалого застосування [5, 17].
Окрім циклооксигенази, існує ліпоксигеназа (LOX), яка є важливим ферментом для перетворення арахідонової кислоти в ейкозаноїди. Альтернативний біосинтетичний шлях активується 5-ліпоксигеназою (5-LOX) та забезпечує утворення молекул, що необхідні для ініціації імунологічних реакцій, появи та усунення запалення. Лейкотрієн В4, медіатор атеросклерозу, раку та серцево-судинних захворювань, виробляється на фінальному етапі шляху 5-LOX. Таким чином, зниження лейкотрієнів при інгібуванні 5-LOX може зменшити вплив селективних інгібіторів ЦОГ-2 і ЦОГ-1 на серцево-судинну та травну системи.
Вважається, що подвійні інгібітори ЦОГ/5-LOX мають численні терапевтичні переваги порівняно з традиційними НПЗП. По-перше, вони діють на два основні шляхи метаболізму арахідонової кислоти і мають широкий спектр протизапальної активності. По-друге, препарати забезпечують посилений захист шлунка та кращий серцево-судинний профіль [13]. Як наслідок, останніми роками було докладено значних зусиль для розробки інгібіторів ЦОГ/5-LOX подвійної дії, що дало дуже обнадійливі результати [15].
Кетопрофену лізинова сіль (Кетолізин) — особливості та механізм дії при хронічному болі
Серед представників НПЗП, які найчастіше застосовуються у клінічній практиці, кетопрофен займає особливе місце. Завдяки низці особливостей механізму дії він має важливе клінічне значення в терапії хронічного нейропатичного болю, забезпечує виражену протизапальну та знеболювальну дію [14]. Однак кетопрофен, як і значна кількість інших НПЗП, є слабкою кислотою, тому дуже погано розчиняється у воді, мінімально розчиняється в кислому середовищі шлунка та вкрай обмежено розчиняється в рідинах ШКТ. Ці особливості призводять до його нерівномірної абсорбції та нестабільної біодоступності [14].
Для поліпшення фармакокінетичних якостей діючих речовин, які погано або повільно всмоктуються чи розчиняються, є численні методи солюбілізації: зменшення розміру частинок, диспергування твердих речовин, комплексоутворення, утворення солі, кокристалізація та інкапсуляція наночастинок. Останніми роками зріс інтерес до дослідження та використання амінокислот через їх безпечність та переносимість. Амінокислоти належать до категорії GRAS (Generally Recognized as Safe) і використовуються як біологічно активні добавки. Вони бувають амфотерні (наприклад, гліцин і аланін), кислі (наприклад, аспарагінова кислота і глутамінова кислота) або основні (наприклад, аргінін і лізин). Крім того, амінокислоти успішно використовуються для розчинення як іонізованих, так і неіонізованих препаратів.
Кетопрофену лізинова сіль (Кетолізин) — сполука кетопрофену та L-лізину у формі солі. Підвищення розчинності цієї молекули відбувається шляхом електростатичної взаємодії та залужувальних ефектів застійного дифузійного шару навколо частинок основних і допоміжних речовин у розчиннику, що посилює іонізацію слабко кислотного препарату. Дифузійний шар стає більш лужним, і відбувається більш сильна іонізація, що сприяє солюбілізації слабкої кислоти кетопрофену [27].
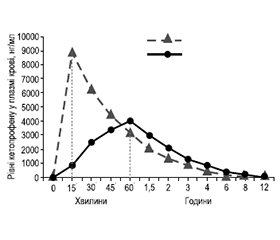
Оскільки КЛС має кращу розчинність порівняно з кислим кетопрофеном, це сприяє більш швидкому і повному всмоктуванню активної речовини. Висока пікова концентрація в сироватці крові досягається через 15 хвилин після перорального прийому КЛС порівняно з 60 хвилинами після введення кетопрофену. Таке збільшення пікової концентрації КЛС у плазмі крові призводить до більш швидкої фармакологічної активності. При цьому аналгетична активність спостерігається через 30 хвилин після першого перорального прийому в статистично значущій модальності порівняно з плацебо [5, 17].
Підвищена розчинність у воді, швидке всмоктування, висока біодоступність та достатній період напіввиведення формують оптимальний фармакокінетичний профіль кетопрофену лізинової солі. Лікарська форма гранул для орального розчину дозволяє приймати КЛС вже у водному розчині, що сприяє швидкому підвищенню концентрації в плазмі крові та досягненню пікової плазмової концентрації [14]. КЛС має досить пролонгований ефект (до 6 годин), що робить її використання корисним при лікуванні гострого та загострення хронічного болю [10].
Кетопрофену лізинова сіль (Кетолізин) — подвійний інгібітор ЦОГ/5-LOX, який пригнічує не тільки фермент циклооксигеназу, а ще й ліпоксигеназу, що забезпечує альтернативний шлях метаболізму арахідонової кислоти з утворенням лейкотрієнів. Зменшення руйнування тканин під час запалення відбувається шляхом стабілізації лізосомальних мембран, запобігання вивільненню лізосомальних ферментів та інгібування брадикініну.
КЛС, на відміну від інших НПЗП, має як периферичні, так і центральні напрямки активності в результаті пригнічення біосинтезу центрального простагландину шляхом інгібування ЦОГ мозку та синтази оксиду азоту [23]. Це відіграє важливу роль у лікуванні болю, оскільки саме вплив на центральні механізми передачі та сприйняття больових імпульсів приводить до зменшення вироблення больової субстанції P.
/20.jpg)
Центральний механізм дії Кетолізину полягає, по-перше, у зниженні аферентного сигналу від больових рецепторів шляхом пригнічення AMPA-рецепторів (канали іонів Na+, медіатори глутамату) та нейрокінінових (NK) рецепторів при зміні рівня G-протеїну постсинаптичної мембрани (медіатори субстанції P і NKA). По-друге, у зменшенні центральної активації збудження завдяки пригніченню рецепторів NMDA (канали іонів Ca2+, медіатори глутамату). Кетолізин приводить до блокади іонних каналів больових рецепторів через вплив на NMDA-рецептори глутамату, альтерацію зв’язку G-протеїнів з NK-рецепторами, отже, після використання КЛС у крові підвищується рівень -ендорфінів і вірогідно знижується рівень субстанції Р, чого не відбувається під час прийому іншого НПЗП [10, 26].
Периферичний механізм дії більшості НПЗП реалізується через пригнічення прозапальних простагландинів (ПГЕ2). У цьому аспекті дія КЛС також є високоефективною — препарат перевершує вплив на ПГЕ2 інших неселективних засобів [26].
Таким чином, центральний механізм дії реалізується як наслідок інгібування ліпоксигеназного, а периферичний — циклооксигеназного шляху, завдяки чому КЛС має кращий аналгетичний та протизапальний ефект, ніж інші НПЗП [26]. Це пояснює вплив Кетолізину на патогенетичні механізми виникнення як гострого, так і хронічного болю, більш швидкий, безпечний та виражений ефект усунення больового синдрому [5, 22, 26, 27].
Порівняння КЛС з іншими видами НПЗП для лікування різних видів болю
Біль у попереку є одним із найпоширеніших станів, з яким стикаються лікарі у клінічній практиці та який потребує призначення ліків. Гострий біль у попереку зазвичай визначається при тривалості симптомів менш ніж 6 тижнів, підгострий біль — від 6 до 12 тижнів, хронічний біль — протягом 12 тижнів або більше. Для більшості пацієнтів з болем у попереку, незалежно від тривалості симптомів, ацетамінофен та НПЗП є вибором першої лінії для полегшення болю, згідно з APS/ACP та європейськими рекомендаціями [5].
Варто відзначити, що вищий відсоток пацієнтів, які отримували кетопрофен, відчули полегшення болю всього за 1 годину порівняно з групою індометацину (61 проти 46,9 %). Інше дослідження за участю 155 пацієнтів з хронічним поперековим болем показало, що пероральний кетопрофен (150 мг/добу) продемонстрував вищі показники поліпшення через 1 тиждень після прийому порівняно з диклофенаком (75 мг/добу) і, таким чином, швидший початок аналгетичної ефективності (у 71,4 проти 62,36 % відповідно) [5].
Було показано, що при використанні КЛС зменшується ризик побічного ефекту у вигляді виразки шлунка порівняно з кислою формою кетопрофену. Ймовірно, це пов’язано із залишковими аміногрупами L-лізину, які діють як поглиначі карбонільних речовин, забезпечуючи захист від окисного пошкодження слизової оболонки шлунка. Також вони проявляють непрямі антиоксидантні ефекти та підвищують рівень глутатіону S-трансферази Р на клітинному рівні в слизовій оболонці шлунка. Крім того, L-лізин поліпшує цілісність слизової оболонки та має гастропротекторну дію завдяки донорству оксиду азоту (NO) [12, 14]. Оскільки НПЗП є відомими індукторами утворення активних форм кисню (АФК), а шлунково-кишковий тракт дуже схильний до атаки АФК, підвищену толерантність до КЛС пояснювали зменшенням ефектів перекисного окиснення ліпідів та поглинанням АФК амінокислотою L-лізином, наявність якої була пов’язана з пригніченням регуляції сигналів окисного стресу [17].
Для препаратів групи НПЗП важливе значення мають вираженість, швидкість розвитку та тривалість збереження клінічного ефекту. Такі показники фармакокінетики, як час досягнення максимальної концентрації діючої речовини в плазмі крові (Cmax) та час збереження в плазмі крові такої концентрації діючої речовини, що забезпечує виражений клінічний ефект (T1/2), відрізняють Кетолізин від інших нестероїдних протизапальних препаратів.
Механізми дії молекул кетопрофену та КЛС тотожні [14]. Це дозволяє екстраполювати переваги кетопрофену порівняно з іншими НПЗП на модифіковану молекулу КЛС, але при цьому дія КЛС настає швидше та триває довше, що підтверджено низкою досліджень [16, 17, 19]. Крім цього, проведено достатню кількість РКД, у яких дію інших НПЗП порівнювали безпосередньо з КЛС [14].
У цікавому багатоцентровому подвійному сліпому дослідженні за участю 165 пацієнтів з травматичними спортивними травмами, що супроводжувалися болем, порівнювали знеболювальну ефективність тижневого лікування кетопрофеном (50 мг/b.i.d. per os) та ібупрофеном (600 мг/b.i.d per os). При цьому виявили, що полегшення симптомів на 50 % було досягнуто у більшої кількості пацієнтів, які отримували кетопрофен (76 проти 58 %), і за коротший час [26].
Метою ще одного систематичного огляду літератури та метааналізу РКД було порівняння аналгетичної ефективності кетопрофену з дією ібупрофену та диклофенаку.
Метааналіз був зроблений на основі 13 статей, у яких порівнювали кетопрофен з ібупрофеном (вісім РКД) [9, 22–28] або диклофенаком (п’ять РКД) [17–21]. При відборі досліджень автори враховували дотримання терапевтичних доз та однорідність розмірів ефекту: кетопрофен, ібупрофен та диклофенак застосовувалися у відповідних терапевтичних діапазонах 50–200, 600–1800 та 75–150 мг/добу. Вказані дози відповідали таким, що рекомендовані для лікування помірного та тяжкого болю.
Результати показали, що ефект від терапевтичних доз кетопрофену був набагато більшим, ніж від терапевтичних доз ібупрофену або диклофенаку [9, 17–28], а чотири дослідження [9, 20, 25, 28] виявили, що кетопрофен починав діяти раніше, ніж два інші препарати. Ці результати свідчать про статистично значуще поліпшення стану пацієнтів при використанні кетопрофену, що підкреслює високу ефективність препарату [22].
До зазначених вище переваг КЛС порівняно з іншими НПЗП слід додати його виражену здатність проникати крізь гематоенцефалічний бар’єр — відповідно, значущо впливати на центральні механізми знеболювання та нейросенсорне запалення [14].
Кетопрофен, як і інші НПЗП, виявляє свою дію на периферичні та центральні ділянки шляхом пригнічення як оксиду азоту (NO), так і ЦОГ-синтази в головному мозку [29, 30]. У дослідженні Gynther et al. [31] оцінили поглинання кетопрофену-лізину мозком і продемонстрували більш швидке поглинання КЛС порівняно з кетопрофеном. Ці результати підтверджують, що саліфікація кетопрофену сприяє швидшому проходженню крізь гематоенцефалічний бар’єр. Крім того, КЛС досягає свого максимального піку в плазмі крові одночасно з її присутністю в ЦНС [10, 31]. Такі особливості пояснюють швидкий початок дії, притаманний кетопрофену лізинової солі порівняно з кислим кетопрофеном та іншими НПЗП [10].
КЛС має ширший спектр показань на відміну від більшості НПЗП. Завдяки своїй неселективності препарат є оптимальним вибором для зменшення ризику побічних ефектів. При його використанні спостерігається зниження випадків серцево-судинних ускладнень, менш агресивний вплив на шлунково-кишковий тракт, нижча системна токсичність. Це дозволяє використовувати кетопрофен для більш тривалого лікування болю або запалення.
Нещодавні доклінічні дослідження продемонстрували синергічну дію кетопрофену, лізину та габапентину, високу ефективність та хорошу шлунково-кишкову переносимість цієї комбінації як при гострому, так і при хронічному нейропатичному болі [24].
У цьому дослідженні оцінювалися окремі НПЗП щодо імовірності розвитку побічних ефектів та ускладнень: гострого інфаркту міокарда, серцевої недостатності, ішемічного порушення мозкового кровообігу. Серед відібраних НПЗП кетопрофен, за яким йдуть мелоксикам, целекоксиб і напроксен, продемонстрував найнижчий відносний ризик ішемічних порушень мозкового кровообігу. Згідно з останніми даними виявляється, що при клінічних проявах запального болю, наприклад болю у попереку та остеоартриті, слід віддавати перевагу неселективним НПЗП. У таких випадках кетопрофен з лізином мають сприятливий баланс між ефективністю та безпекою [10].
При лікуванні пацієнтів з вертебральним синдромом (люмбаго, ішіас) кетопрофен продемонстрував суттєве зменшення вираженості болю та підвищення мобільності. Клінічна ефективність та безпека застосування — дві основні та суттєві сторони фармакотерапії, тому дуже важливо, що молекула КЛС поєднує виражену ефективність із суттєво поліпшеним профілем безпеки [14].
Вивчення профілю безпеки КЛС in vitro на епітеліальних клітинах шлунка людини показало, що кетопрофену лізинова сіль (Кетолізин) протидіє пошкодженню, що викликане етанолом або НПЗП, шляхом інгібування медіаторів запалення та підвищення активності гастропротекторних білків (муцину). Це зумовлює підвищення життєздатності клітин слизової оболонки і поліпшення її цілісності. Дослідження in vivo підтвердили ці дані та одночасно продемонстрували зменшення можливого негативного впливу НПЗП на нирки. Ця інформація підкріплює концепцію про те, що L-лізин (у складі молекули Кетолізину) може протидіяти опосередкованому стресом ураженню ШКТ та нирок [14].
Результати метааналізу, в якому оцінювали ефективність перорального застосування кетопрофену для полегшення помірно вираженого болю, поліпшення функціонального стану та загального стану (13 РКД за участю 898 пацієнтів; вісім порівнювали кетопрофен з ібупрофеном, а п’ять порівнювали кетопрофен з диклофенаком), показали статистично значущу різницю в ефективності на користь кетопрофену. Різниця між кетопрофеном та об’єднаними даними щодо ібупрофену/диклофенаку також була статистично більш значущою, ніж при застосуванні ібупрофену та/або диклофенаку [22].
У зв’язку з великою ймовірністю дозозалежного та часозалежного виникнення побічних ефектів при тривалому використанні (серцево-судинні, шлунково-кишкові ускладнення тощо) НПЗП зазвичай приймають коротким курсом. Тому велику клінічну значущість має вивчення результатів тривалого використання КЛС. Загалом 823 пацієнти з хронічним болем були включені в міжнародне проспективне дослідження, спрямоване на оцінку профілю безпеки кетопрофену протягом 12-місячного періоду лікування. Пацієнти отримували перорально кетопрофен у дозі 200 мг один раз на добу. Наприкінці дослідження 521 пацієнт (63,3 %) залишався на схемі лікування, тоді як 302 пацієнти (36,7 %) припинили лікування з різних причин (побічні реакції, поліпшення, неефективність, втрата спостереження тощо). Більшість небажаних явищ (побічних ефектів) відбулися протягом перших 3 місяців дослідження у 314 пацієнтів (38,2 %). Таким чином, можна дійти висновку, що пролонговане вживання кетопрофену у дозуванні 200 мг один раз на добу є безпечним при тривалому лікуванні пацієнтів похилого віку для полегшення хронічного болю [32].
Висновки
Кетопрофен широко використовується в лікуванні хронічних захворювань і післяопераційного болю, а також у пацієнтів з гострим ревматичним болем і пов’язаними з ним бурситом, тендинітом, періартритом і болем у попереку. Ефективність та безпека кетопрофену була підтверджена багатьма науковими дослідженнями. Препарат забезпечує кращу знеболювальну дію, більше та швидше полегшення болю із загальним хорошим профілем переносимості. Кетопрофен може бути оптимальним препаратом для лікування болю у названих вище категорій пацієнтів [5].
Саліфікація кетопрофену з утворенням кетопрофену лізинової солі (Кетолізину) надає ще більше переваг у лікуванні болю завдяки поліпшенню фармакокінетичних та фармакодинамічних властивостей:
— Кетолізин має оптимальний фармакокінетичний профіль — підвищена розчинність у воді, швидке всмоктування та висока біодоступність (максимальна пікова концентрація в плазмі крові спостерігається вже через 15 хвилин, аналгетична активність — через 30 хвилин після першого перорального прийому), достатній період напіввиведення (тривалість ефекту до 6 годин) [14];
— Кетолізин з легкістю проходить через гематоенцефалічний бар’єр [10, 31] на відміну від будь-якого іншого НПЗП, завдяки чому може впливати на периферичні та центральні механізми знеболювання та нейросенсорне запалення. Таким чином він безпосередньо діє на патофізіологію нейропатичного болю;
— Кетолізин має не тільки виражену протизапальну, знеболювальну та жарознижувальну дію при багатьох станах, а й поліпшений профіль безпеки: гастро- та нефропротекторна дія, зменшення небажаних реакцій з боку серцево-судинної системи (низький ризик тромбозів та коагулопатій);
— Кетолізин можна призначати довше ніж 12 тижнів. Це важлива перевага для лікування хронічного болю, оскільки не всі НПЗП можуть використовуватись тривалий час через велику кількість побічних ефектів.
Таким чином, Кетолізин є перспективним препаратом для лікування як гострого, так і хронічного болю завдяки швидкому початку дії, високій ефективності та поліпшеному профілю безпеки. Це робить його оптимальним вибором серед сучасних НПЗП.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 06.06.2025
Рецензовано/Revised 14.07.2025
Прийнято до друку/Accepted 21.07.2025
Список литературы
1. Colvin, L.A., Lambert, D.G. Pain medicine: advances in basic sciences and clinical practice. British Journal оf Anaesthesia 101.1 (2008): 1-4.
2. Waddell, G., et al. A Fear-Avoidance Beliefs Questionnaire (FABQ) and the role of fear-avoidance beliefs in chronic low back pain and disability. Pain 52.2 (1993): 157-168.
3. Turk, D.C., Wilson, H.D. Fear of pain as a prognostic factor in chronic pain: conceptual models, assessment, and treatment implications. Current Pain аnd Headache Reports 14 (2010): 88-95.
4. Anderson, K.O., Green, Ca.R., Payne, R. Racial and ethnic disparities in pain: causes and consequences of unequal care. The Journal оf Pain 10.12 (2009): 1187-1204.
5. Sarzi-Puttini, P., et al. Pain and ketoprofen: what is its role in clinical practice? Reumatismo 62.3 (2010): 172-188.
6. Manchikanti, L., et al. Practice Guidelines. Pain Physician 3.1 (2000): 7-42.
7. Baron, R., Binder, A., Wasner, G. Neuropathic pain: diagnosis, pathophysiological mechanisms, and treatment. The Lancet Neurology 9.8 (2010): 807-819.
8. Yunus, M.B. Fibromyalgia and overlapping disorders: the uni-fying concept of central sensitivity syndromes. Seminars in Arthritis аnd Rheumatism 36.6. WB Saunders, 2007.
9. Vlaeyen, J.W.S., Crombez, G. Fear of movement/(re) injury, avoidance and pain disability in chronic low back pain patients. Ma–nual Therapy 4.4 (1999): 187-195.
10. Varrassi, G., et al. Towards an effective and safe treatment of inflammatory pain: a Delphi-guided expert consensus. Advances in Therapy 36.10 (2019): 2618-2637.
11. Meeus, M., Nijs, J. Central sensitization: a biopsychosocial explanation for chronic widespread pain in patients with fibromyalgia and chronic fatigue syndrome. Clinical Rheumatology 26.4 (2007): 465-473.
12. Staud, R. Evidence of involvement of central neural mechanisms in generating fibromyalgia pain. Current Rheumatology Reports 4.4 (2002): 299-305.
13. Bradesi, S. Role of spinal cord glia in the central processing of peripheral pain perception. Neurogastroenterology & Motility 22.5 (2010): 499-511.
14. Бездітко, Н.В. Як досягти швидкого та тривалого знеболювального і протизапального ефекту, або Навіщо лікарю знан-ня з фармакокінетики? Ukr Med J 1663 (2024). doi: 10.32471/umj.1680-3051.163.257242.
15. Rudrapal, M., et al. Dual synergistic inhibition of COX and LOX by potential chemicals from Indian daily spices investigated through detailed computational studies. Scientific reports 13.1 (2023): 8656.
16. Griffin, J.P., Posner, J., Barker, G.R. The Textbook of Pharmaceutical Medicine (2006).
17. Novelli, R., et al. Ketoprofen lysine salt has a better gastrointestinal and renal tolerability than ketoprofen acid: A comparative tolerability study in the Beagle dog. Biomedicine & Pharmacotherapy 153 (2022): 113336.
18. Єгудіна, Є.Д. Уроки 20-річного досвіду роботи з інгібіторами ЦОГ-2: як трактувати результати порівняльних досліджень? Ukr Med J 166 (2023): 261372. doi: 10.32471/umj.1680-3051.166.261372.
19. FitzGerald, G.A., Patrono, C. The coxibs, selective inhibitors of cyclooxygenase-2. New England Journal of Medicine 345.6 (2001): 433-442.
20. Patrono, C., Patrignani, P., Garca Rodrguez, L.A. Cyclooxygenase-selective inhibition of prostanoid formation: transducing biochemical selectivity into clinical read-outs. The Journal of Clinical Investigation 108.1 (2001): 7-13.
21. Kim, G.-H. Renal effects of prostaglandins and cyclooxyge–nase-2 inhibitors. Electrolytes & Blood Pressure 6.1 (2008): 35-41.
22. Sarzi-Puttini, P., et al. Efficacy of ketoprofen vs. ibuprofen and diclofenac: a systematic review of the literature and meta-analysis. Clin Exp Rheumatol 31.5 (2013): 731-8.
23. Whelton, A., Hamilton, C.W. Nonsteroidal anti-inflammatory drugs: effects on kidney function. The Journal of Clinical Pharmaco–logy 31.7 (1991): 588-598.
24. Snowden, S., Nelson, R. The effects of nonsteroidal anti-inflammatory drugs on blood pressure in hypertensive patients. Cardio–logy in Review 19.4 (2011): 184-191.
25. Настанова 00931. Хронічний біль. 2017 [Електронний ресурс]. Режим доступу: https://guidelines.moz.gov.ua/documents/3686.
26. Chichasova, N.V., et al. New approaches to the treatment of pain conditions in clinical practice. Russ Med J Med Rev 21.3 (2013): 134-138.
27. Abou-Taleb, H.A., et al. Exploration of the safety and solubilization, dissolution, analgesic effects of common basic excipients on the NSAID drug ketoprofen. Pharmaceutics 15.2 (2023): 713.
28. Kuczynska, J., Nyaradzo-Iwanicka, B. New uses of ketoprofen — a review of studies from 2015 to 2021. Current Issues in Pharmacy and Medical Sciences 35.1 (2022): 16-20.
29. Ossipov, M.H., et al. Differential effects of spinal (R)-ketoprofen and (S)-ketoprofen against signs of neuropathic pain and tonic nociception: evidence for a novel mechanism of action of (R)-ketoprofen against tactile allodynia. Pain 87.2 (2000): 193-199.
30. Daz-Reval, M.I., et al. Evidence for a central mechanism of action of S-(+)-ketoprofen. European Journal оf Pharmacology 483.2-3 (2004): 241-248.
31. Gynther, M., et al. Brain uptake of ketoprofen–lysine prodrug in rats. International Journal оf Pharmaceutics 399.1-2 (2010): 121-128.
32. Schattenkirchner, M. Long-term safety of ketoprofen in an elderly population of arthritic patients. Scandinavian Journal of Rheumatology 20.sup91 (1991): 27-36.
/20.jpg)

/21.jpg)