Резюме
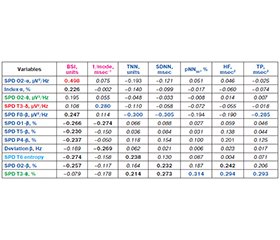
Актуальність. Раніше ми показали, що п’ять кількісно-якісних кластерів артеріального тиску (АТ) дуже чітко відрізняються один від одного за віком, статтю та комплексом нейроендокринних, імунних та метаболічних змінних, які ми назвали тензіорегуломом. Мета: деталізувати концепцію тензіорегулому стосовно нейрогенного супроводу. Матеріали та методи. Під спостереженням перебувало 44 пацієнти з хронічним пієлонефритом та холециститом у фазі ремісії. Тестування проводилося двічі. Об’єктами дослідження були АТ і параметри електроенцефалографії (ЕЕГ) та варіабельності серцевого ритму (ВСР). Результати. За допомогою методу кластерного аналізу проведено природну, на відміну від попередньої штучної, класифікацію пацієнтів з урахуванням не лише систолічного, а й діастолічного АТ. Було виявлено 6 кількісно-якісних кластерів: артеріальна гіпертензія (АГ) II (6,8 %), систолічна АГ I (9,1 %), АГ I (23,9 %), високий нормальний АТ (20,5 %), нормальний АТ (22,7 %), низький нормальний АТ (17,0 %). Окрім параметрів артеріального тиску за замовчуванням, за допомогою дискримінантного аналізу визначено 5 змінних дельта-, 2 тета-, 4 альфа- й 12 бета-ритмів, а також ентропію ЕЕГ у локусі O2 і ВСР-маркер вагусного тонусу як характерні для кластерів. Точність класифікації становить 100 %. Ще 6 змінних ВСР та 10 ЕЕГ виявилися поза дискримінантною моделлю, незважаючи на чітку здатність до розпізнавання. Серед них визначено 3 гіпертензивні та 12 гіпотензивних нейрогенних факторів для систолічного АТ, а також 11 гіпертензивних і 9 гіпотензивних для діастолічного АТ. Було виявлено сильну канонічну кореляцію між змінними ЕЕГ та ВСР (R = 0,768). Нейрогенні регуляторні фактори пояснюють 61,6 % варіабельності систолічного та діастолічного АТ. Висновки. Широкий спектр артеріального тиску — від низького нормального до АГ II — супроводжується специфічною електричною активністю структур центральної та вегетативної нервової систем, що визначає артеріальний тиск на 61,6 %.
Background. Earlier we showed that five qualitative-quantitative clusters of blood pressure (BP) are very clearly different from each other by age, sex and the constellation of neuro-endocrine, immune and metabolic variables, which we called the tensioregulome. The purpose of this study is to detail this concept in relation to neurogenic accompaniment. Materials and methods. Under observation, there were 44 patients with chronic pyelonephritis and cholecystitis in the phase of remission. Testing was performed twice. The objects of the study were BP and parameters of electroencephalography (EEG) and heart rate variability (HRV). Results. Using the cluster analysis method, a natural, in contrast to the previous artificial, classification of patients was carried out, taking into account not only systolic, but also diastolic BP. Six quantitative-qualitative clusters were identified: arterial hypertension (AH) II (6.8 %), AH I systolic (9.1 %), AH I (23.9 %), high norm (20.5 %), norm (22.7 %), low norm (17.0 %). In addition to BP parameters by default, 5 delta-, 2 theta-, 4 alpha-, and 12 beta-rhythms variables as well as EEG entropy in O2 locus and HRV-marker of vagal tone were identified by discriminant analysis as characteristic for clusters. The classification accuracy is 100 %. Another 6 HRV and 10 EEG variables were found to be out of the discriminant model, despite the clear recognition ability. Among them, 3 hypertensive and 12 hypotensive neurogenic factors were identified for systolic BP and 11 hypertensive and 9 hypotensive for diastolic BP. A strong canonical correlation between EEG and HRV variables was found (R = 0.768). The neurogenic regulatory factors explained 61.6 % of the variability in systolic and diastolic BP. Conclusions. A wide spectrum of blood pressure — from low normal to AH II — is accompanied by specific electrical activity of structures of the central and autonomic nervous systems, which determines BP by 61.6 %.
Список литературы
1. Celis H, Staessen JA, Thijs L, Buntinx F, De Buyzere M, Den Hond E, et al. Systolic hypertension in Europe (Syst-Eur) trial phase 2: objectives, protocol, and initial progress. Journal of Human Hypertension. 2005;19(1):73-79.
2. Whelton PK, Carey RM, Aronow WS, Casey DE, Collins KJ, Himmelfarb CD, et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA guideline for the prevention, detection, evaluation, and management of high blood pressure in adults: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Journal of the American College of Cardiology. 2018;71(19):e127-e248.
3. Lin HJ, Wang TD, Yu-Chih Chen M, et al. 2020 Consensus Statement of the Taiwan Hypertension Society and the Taiwan Society of Cardiology on Home Blood Pressure Monitoring for the Management of Arterial Hypertension. Acta Cardiol Sin. 2020;36(6):537-561.
4. Mancia G, Kreutz R, Brunstrm M, Burnier M, Grassi G, Januszewicz A, et al. 2023 ESH Guidelines for the management of arterial hypertension. The Task Force for the management of arterial hypertension of the European Society of Hypertension. J Hypertens. 2023;41:1874-2071. doi: 10.1097/hjh.0000000000003480.
5. Kozyavkina NV, Vovchyna YV, Voronych-Semchenko NM, Zukow W, Popovych IL. Electroencephalographic accompaniment of quantitative-qualitative blood pressure clusters in patients of Truskavets’ spa. J Educ Health Sport. 2021;11(10):435-444. doi: 10.12775/jehs.2021.11.10.042.
6. Su D, Yang H, Chen Z, Kong Y, Na X, Lin Q, et al. Ethnicity-specific blood pressure thresholds based on cardiovascular and renal complications: a prospective study in the UK Biobank. BMC Med. 2024;22(1):54. doi: 10.1186/s12916-024-03259-5.
7. Kocemba J, Kawecka-Jaszcz K, Gryglewska B, Grodzicki T. Isolated systolic hypertension: pathophysiology, consequences and therapeutic benefits. J Hum Hypertens. 1998;12(9):621-626. doi: 10.1038/sj.jhh.1000676.
8. McEvoy JW, Daya N, Rahman F, Hoogeveen RC, Blumenthal RS, Shah AM, et al. Association of isolated diastolic hypertension as defined by the 2017 ACC/AHA blood pressure guideline with incident cardiovascular outcomes. JAMA. 2020;323:329-338. doi: 10.1001/jama.2019.21402.
9. Kozyavkina NV, Vovchyna YV, Voronych-Semchenko NM, Zukow W, Popovych IL. Tensioregulome concept. Quantitative-quali-tative blood pressure clusters of patients at Truskavets’ spa and their accompaniments. Ternopil. Ukrmedknyha; 2024. 194. doi: 10.5281/zenodo.12664757.
10. Popovych IL, Gozhenko AI, Korda MM, Klishch IM, Po-povych DV, Zukow W, eds. Mineral waters, metabolism, neuro-endocrine-immune complex. Odesa: Feniks; 2022. 252. doi: 10.5281/zenodo.6604298.
11. Baevsky RM, Chernikova AG. Heart rate variability analysis: physiological foundations and main methods. Neurocardiology. 2017;11(1):4-14. doi: 10.12710/cardiometry.2017.10.6676.
12. Berntson GG, Bigger JT, Eckberg DL, Grossman P, Kaufmann PG, Malik M, et al. Heart rate variability: origins, me-thods, and interpretive caveats. Psychophysiology. 1997;34(6):623-648. doi: 10.1111/j.1469-8986.1997.tb02140.x.
13. Heart rate variability. Standards of measurement, physio–logical interpretation, and clinical use. Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysio–logy. Circulation. 1996;93(5):1043-1065. doi: 10.1161/01.cir.93.5.1043.
14. Newberg A, Alavi A, Baime M, et al. The measurement of regional cerebral blood flow during the complex cognitive task of meditation: a preliminary SPECT study. Psychiatry Research: Neuroimaging Section. 2001;106:113-122.
15. Popadynets O, Gozhenko A, Badyuk N, Popovych I, et al. Interpersonal differences caused by adaptogen changes in entropies of EEG, HRV, immunocytogram, and leukocytogram. Journal of Physical Education and Sport. 2020;20(Suppl 2):982-999. doi: 10.7752/jpes.2020.s2139.
16. Gozhenko A, Korda M, Popadynets O, Popovych I. Entropy, harmony, synchronization and their neuro-endocrine-immune correlates. Odesa: Feniks; 2021. 232 (in Ukrainian).
17. Shannon CE. A mathematical theory of information. Bell Syst Tech J. 1948;27:379-423.
18. Jain AK, Murty MN, Flynn PJ. Data clustering: a review. Authors Info & Claims ACM Computing Surveys (CSUR). 1999;31(3):264-323. doi: 10.1145/331499.331504.
19. Klecka WR. Discriminant analysis. Quantitative Applications in the Social Sciences Series. Thousand Oaks, CA: Sage Publications; 1980. 19.
20. Popovych I, Kozyavkina O, Kozyavkina N, et al. Correlation between indices of the heart rate variability and parameters of ongoing EEG in patients suffering from chronic renal pathology. Neurophysio–logy. 2014;46(2):139-148. doi: 10.1007/s11062-014-9420-y.
21. Popovych IL, Kozyavkina NV, Vovchyna YV, Voronych-Semchenko NM, Zukow W, Popovych DV. Tensioregulome as an accompaniment of quantitative-qualitative blood pressure clusters. J Educ Health Sport. 2022;12(6):418-436. doi: 10.12775/jehs.2022.12.06.044.
22. Kozyavkina NV, Popovych IL, Vovchyna YV, Voronych-Semchenko NM, Zukow W, Popovych DV. Evaluation of quantitative-qualitative levels of blood pressure by tensioregulome. J Educ Health Sport. 2022;12(8):1216-1236. doi: 10.12775/jehs.2022.12.08.137.
23. Kuo TB, Chen CY, Hsu YC, Yang CC. EEG beta power and heart rate variability describe the association between cortical and autonomic arousals across sleep. Auton Neurosci. 2016;194:32-37. doi: 10.1016/j.autneu.2015.12.001.
24. Babini MH, Kulish VV, Krejcar O, Namazi H. Decoding of heart-brain relation by complexity-based analysis of heart rate variability (HRV) and electroencephalogram (EEG) signals. Fractals. 2022;30(7):2250190. doi: 10.1142/s0218348x22501900.
25. Attar ET, Balasubramanian V, Subasi E, Kaya M. Stress analysis based on simultaneous heart rate variability and EEG monitoring. IEEE J Transl Eng Health Med. 2021;9:1-7. doi: 10.1109/jtehm.2021.3103190.
26. Chomanskis , Jonkus V, Danielius T, Paulauskas T, Orvydait M, Melaika K, et al. Hypotensive effect of electric stimulation of caudal ventrolateral medulla in freely moving rats. Medicina. 2023;59(6):1046. doi: 10.3390/medicina59061046.
27. Matusik PS, Matusik PT, Stein PK. Heart rate variability in patients with hypertension and its relationship to target organ damage: a systematic review. Front Neurosci. 2023;17:1142818. doi: 10.3389/fnins.2023.1142818.
28. Hirooka Y. Sympathetic activation in hypertension: importance of the central nervous system. Am J Hypertens. 2020;33(10):914-926. doi: 10.1093/ajh/hpaa080.
29. Koichubekov B, Sorokina M. P-217: Effect of heart rate variability biofeedback on brain electrical activity in stage I hypertensive patients. Ann Cardiol Angeiol (Paris). 2015;64:S95. doi: 10.1016/s0003-3928(16)30141-6.
30. Revathy A, Manivannan S, Gayathri A, et al. Effect of Bhramari Pranayama on heart rate variability (HRV) in hypertension: a study protocol for a randomized controlled trial. Indian J Integr Med. 2025;5(1).
31. Maciorowska M, Krzesiski P, Wierzbowski R, Gie–lerak G. Heart rate variability in patients with hypertension: the effect of metabolic syndrome and antihypertensive treatment. Cardiovascular The-rapeutics. 2020;2020:8563135. doi: 10.1155/2020/8563135.
32. Deng Y, Zeng X, Tang C, Hou X, Zhang Y, Shi L. The effect of exercise training on heart rate variability in patients with hypertension: a systematic review and meta-analysis. Journal of Sports Sciences. 2024;42(13):1272-1287. doi: 10.1080/02640414.2024.2388984.
33. Legaz A, Yoris A, Sedeo L, et al. Heart-brain interactions during social and cognitive stress in hypertensive disease: a multidimensional approach. Eur J Neurosci. 2022;55(9–10):2836-2850. doi: 10.1111/ejn.15714.