Журнал «Медицина неотложных состояний» Том 21, №6, 2025
Вернуться к номеру
Моніторинг болю з використанням штучного інтелекту: оцінка болю, застосування аналгетиків та тенденції дозування опіоїдів у пацієнтів із бойовими травмами
Авторы: A. Popelnukha, D.V. Dmytriiev
Vinnytsia National Pirogov Memorial Medical University, Vinnytsia, Ukraine
Center for the Treatment and Rehabilitation of Chronic Pain “Prometheus”, Vinnytsia, Ukraine
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
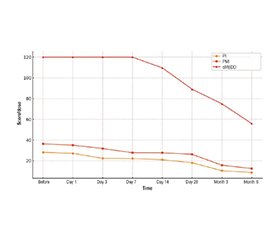
Актуальність. Бойові травми часто супроводжуються вираженим гострим болем, складними режимами аналгезії та підвищеним ризиком тривалого споживання опіоїдів. Інструменти на базі штучного інтелекту (ШІ), як-от Rapid Pain Assessment Tool (R-PAT), відкривають нові можливості для моніторингу в реальному часі та раннього прогнозування довгострокових наслідків болю, включно з тривалим застосуванням опіоїдів. Матеріали та методи. Проведено проспективне когортне дослідження 33 пацієнтів із бойовими пораненнями (середній вік — 32,4 ± 7,8 року; 91 % чоловіки), отриманими внаслідок вибухів (52 %), вогнепальних травм (33 %) або дронових атак (15 %). За допомогою R-PAT здійснювали моніторинг у 8 часових точках — від моменту госпіталізації до 6 місяців після травми. Було оцінено три параметри: індекс болю (PI), індекс аналгетиків (PMI) та добову еквівалентну дозу морфіну per os (oMEDD). Зміни аналізували за допомогою однофакторного дисперсійного аналізу. Прогностичну точність початкових даних для виявлення пацієнтів із високим показником oMEDD через 6 місяців (більше за медіану) визначали за допомогою ROC-аналізу. Результати. Усі три індекси статистично вірогідно знизилися з часом, що свідчить про ефективний контроль болю та поступове зменшення аналгезії (PI: p < 2,0 10–45; PMI:
p < 5,4 10–80; oMEDD: p < 3,5 10–71). ROC-аналіз базових показників із залученням моделей ШI продемонстрував хорошу прогностичну здатність для ідентифікації пацієнтів із високими потребами в опіоїдах: PI_simulated — помірна прогностична цінність (AUC ≈ 0,66–0,72), PMI_simulated — висока (AUC ≈ 0,75–0,80), oMEDD_simulated — дуже висока (AUC ≈ 0,80–0,85). Це свідчить про те, що базові моделі дозування опіоїдів, оброблені за допомогою алгоритмів ШI, мають суттєве прогностичне значення. Індекс oMEDD виявився найточнішим предиктором тривалого використання опіоїдів, перевершуючи як суб’єктивні оцінки болю, так і складність аналгетичної схеми. Висновки. Система R-PAT виявилася ефективною в моніторингу болю та застосування опіоїдів iз часом, а також у прогнозуванні довгострокових потреб в опіоїдах. Базові показники, посилені ШІ, мають високу прогностичну точність, що підтверджує доцільність їх використання для раннього виявлення осіб із ризиком хронізації болю та залежності. Отримані дані свідчать на користь інтеграції інтелектуальних моніторингових систем у ведення пацієнтів із травмою для персоналізованого проактивного менеджменту болю.
Background. Combat-related injuries are frequently associated with intense acute pain, complex analgesic regimens, and an elevated risk of prolonged opioid consumption. Artificial intelligence (AI)-driven tools such as the Rapid Pain Assessment Tool (R-PAT) offer novel opportunities for real-time monitoring and early prediction of long-term pain outcomes, including sustained opioid use. Materials and methods. A prospective cohort of 33 combat-injured patients (mean age 32.4 ± 7.8 years; 91 % male) with blast (52 %), gunshot (33 %), or drone-related (15 %) trauma were monitored using R-PAT across eight timepoints from baseline to six months post-injury. Three indices were evaluated: pain index (PI), pain medication index (PMI), and oral morphine equivalent daily dose (oMEDD). Longitudinal trends were assessed using one-way ANOVA. Predictive accuracy of baseline metrics for high oMEDD at 6 months (above-median threshold) was evaluated using receiver operating characteristic (ROC) analysis. Results. All three indices demonstrated statistically significant reductions over time, reflecting effective pain control and tapering of analgesic interventions (PI: p < 2.0 10–45; PMI: p < 5.4 10–80; oMEDD: p < 3.5 10–71). ROC analysis of AI-enhanced baseline data revealed robust predictive performance for identifying patients with high opioid requirements at six months: PI_simulated — moderate predictive value (AUC ≈ 0.66–0.72), PMI_simulated — strong predictive value (AUC ≈ 0.75–0.80), oMEDD_simulated — very strong predictive value (AUC ≈ 0.80–0.85). This indicates that baseline opioid dosing patterns, when processed through AI-enhanced models, carry substantial prognostic value. oMEDD_simulated was the most accurate early predictor of sustained opioid use, outperforming both subjective pain scores and analgesic complexity. Conclusions. The R-PAT system proved effective not only in tracking pain and opioid usage over time but also in forecasting long-term opioid requirements. AI-augmented baseline metrics demonstrated strong predictive potential, supporting their use in the early identification of high-risk patients. These findings advocate for the integration of intelligent monitoring systems into trauma care to enable personalized, proactive pain management strategies.
бойова травма; моніторинг болю з використанням ШI; післяопераційний біль; дозування опіоїдів; індекс аналгетиків; еквівалент морфіну; R-PAT; прогностичне моделювання; ROC; ANOVA
сombat trauma; AI-assisted pain monitoring; postoperative pain; opioid trends; analgesic index; morphine equivalents; Rapid Pain Assessment Tool; predictive modeling; receiver operating characteristic; ANOVA
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Dmytriiev D. Assessment and treatment of postoperative pain in children. Anaesth Pain Intensive Care. 2018;22(3):392-400.
- Bergauer L, Braun J, Roche TR, et al. Avatar-based patient monitoring improves information transfer, diagnostic confidence and reduces perceived workload in intensive care units: computer-based, multicentre comparison study. Sci Rep. 2023;13:5908. doi: 10.1038/s41598-023-33027-z.
- Tscholl DW, et al. Using an animated patient avatar to improve perception of vital sign information by anaesthesia professionals. Br J Anaesth. 2018;121(3):662-671. doi: 10.1016/j.bja.2018.04.024.
- Dmytriiev D. Multiple organ dysfunction syndrome: what do we know about pain management? A narrative review. Anaesth Pain Intensive Care. 2019;23(1):84-91.
- Tscholl DW, Weiss M, Handschin L, et al. User perceptions of avatar-based patient monitoring: a mixed qualitative and quantitative study. BMC Anesthesiol. 2018;18:188. doi: 10.1186/s12871-018-0650-1.
- Garot O, Rssler J, Pfarr J, et al. Avatar-based versus conventional vital sign display in a central monitor for monitoring multiple patients: a multicenter computer-based laboratory study. BMC Med Inform Decis Mak. 2020;20:26. doi: 10.1186/s12911-020-1032-4.
- Roche TR, et al. Avatar-based patient monitoring in critical anaesthesia events: a randomised high-fidelity simulation study. Br J Anaesth. 2021;126(5):1046-1054. doi: 10.1016/j.bja.2021.01.015.
- Dobrovanov O, Dmytriiev D, Prochotsky A, Vidiscak M, Furkova K. Pain in COVID-19: quis est culpa? Electron J Gen Med. 2023;20(1):em435. doi: 10.29333/ejgm/12672.
- Marcilly R, Peute L, Beuscart-Zephir MC. From usability engineering to evidence-based usability in health IT. Stud Health Technol Inform. 2016;222:126-138.
- Wung SF. Human factors and technology in the ICU. Crit Care Nurs Clin North Am. 2018;30(2). doi: 10.1016/j.cnc.2018.03.001.
- Waller RG, Wright MC, Segall N, et al. Novel displays of patient information in critical care settings: a systematic review. J Am Med Inform Assoc. 2019;26(5):479-489. doi: 10.1093/jamia/ocy193.
- Schulz CM, Burden A, Posner KL, et al. Frequency and type of situational awareness errors contributing to death and brain damage: a closed claims analysis. Anesthesiology. 2017;127(2):326-337. doi: 10.1097/aln.0000000000001661.
- Dobrovanov O, Dmytriiev D, Prochotsky A, Vidiscak M, Furkova K. Chronic pain in post-COVID syndrome. Bratisl Med J. 2023;124(2):97-103. doi: 10.4149/bll_2023_014.
- Lisnyy I, Zakalska O, Dmytriiev D, Dmytriiev K, Dobrovanov O. Pre-emptive analgesia with nonsteroidal anti-inflammatory drugs: randomi–zed, double-blind placebo-controlled study. Lek Obzor. 2021;70(5):195-202.
- Alowais SA, Alghamdi SS, Alsuhebany N, et al. Revolutio–nizing healthcare: the role of artificial intelligence in clinical practice. BMC Med Educ. 2023;23:689. doi: 10.1186/s12909-023-04698-z.
- Buch VH, Ahmed I, Maruthappu M. Artificial intelligence in medicine: current trends and future possibilities. Br J Gen Pract. 2018;68(668):143-144. doi: 10.3399/bjgp18x695213.
- Cabral BP, Braga LAM, Conte Filho CG, et al. Future use of AI in diagnostic medicine: 2-wave cross-sectional survey study. J Med Internet Res. 2025;27:e53892. doi: 10.2196/53892.
- Salomon I, Olivier S. Artificial intelligence in medicine: advantages and disadvantages for today and the future. Int J Surg Open. 2024;62(4):471-473. doi: 10.1097/io9.0000000000000133.
- Popelnukha A, Dmytriiev D. Rapid Pain Assessment Tool avatar self-pain report: a new objective method for adequate pain diagnosis? Pilot study. Emerg Med. 2025;21(4):394-397. doi: 10.22141/2224-0586.21.4.2025.1887.
- McCulloch Gallagher R, Sandbrink F. The socioeconomic burden of pain from war. Am J Public Health. 2019;109(1):41-45. doi: 10.2105/ajph.2018.304744.
- Battle C, Baker E, Dmytriiev D. Predictors of chronic pain, chronic opioid use and neuropathic pain in Ukrainian military patients with isolated thoracic injuries sustained during the Russia-Ukraine conflict: a single-centre prospective observational study. Eur J Trauma Emerg Surg. 2025;51(1):237. doi: 10.1007/s00068-025-02914-7.