Журнал «Травма» Том 26, №4, 2025
Вернуться к номеру
Вивчення комбінованої дії модулюючих факторів на репаративний остеогенез
Авторы: S.V. Konovalenko (1), V.V. Protsenko (2), V.H. Tykhonov (1), Ye.O. Solonitsyn (2), Yu.K. Hrebennikov (3), V.F. Konovalenko (1), M.K. Ternovyi (1)
(1) - R.E. Kavetsky Institute of Experimental Pathology, Oncology and Radiobiology of NASU, Kyiv, Ukraine
(2) - Institute of Traumatology and Orthopedics of NAMSU, Kyiv, Ukraine
(3) - Kyiv City Clinical Hospital 12, Kyiv, Ukraine
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
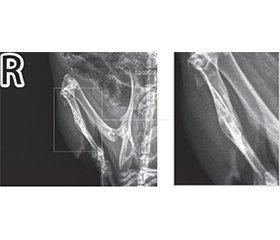
Актуальність. На сучасному етапі продовжуються експериментальні дослідження та клінічні спостереження з метою розробки нових методів лікування для покращення загоєння переломів кісток. В епоху зростання захворюваності на первинні злоякісні й метастатичні пухлини кісток, а також у часи травматичної епідемії під час війни вивчення можливостей впливу на перебіг кісткової репарації з метою її прискорення або покращення є обґрунтованим напрямом експериментальних досліджень. Мета: вивчити вплив модулюючих факторів — інфрачервоного лазерного випромінювання, кальцитоніну та пробіотика на основі Bifidobacterium animalis — на загоєння кісткового дефекту в експерименті in vivo. Матеріали та методи. В експерименті in vivo вивчено репаративний остеогенез у 32 тварин (щури Wistar), великогомілкову кістку яких травмували стоматологічним буром, використовуючи кетаміновий наркоз. Вплив модулюючих факторів на формування кісткової мозолі оцінювали за допомогою дослідження ушкоджених кінцівок тварин з використанням рентген-діагностичної системи Toshiba Radrex потужністю 80 кВт із дозою випромінювання при цифровій рентгенографії 0,03 мЗв; укладка вентродорсальна (на животі, спиною наверх), а також права латеральна (бокові зйомки). Результати. Дослідження показало, що формування кісткової мозолі під впливом лазера йде активно, але нелінійно і не завжди симетрично, що перекликається з результатами, отриманими в інших дослідженнях. У цій роботі вперше приділено увагу вивченню поєднаного впливу одразу декількох модулюючих факторів на репаративний остеогенез, а саме лазерного випромінювання, гормону кальцитоніну й пробіотика. Слід зазначити, що максимальний стимулюючий вплив на формування кісткової мозолі в експериментальних тварин спостерігався в групі «лазер + кальцитонін», що можна охарактеризувати навіть як надмірну репаративну активність кісткової тканини. Натомість у групах, де був присутній пробіотик, репаративний остеогенез у щурів проходив більш гармонійно, демонструючі кращі рентгенологічні результати, як, наприклад, у групі «кальцитонін + пробіотик» і особливо в групі, де препарат B.animalis був поєднаний із лазером та введенням кальцитоніну. Можна обґрунтовано припустити, що здатність B.animalis нормалізувати кальцієвий метаболізм створює умови для репаративного остеогенезу, максимально наближеного до фізіологічного сценарію. Висновки. Поєднання кальцитоніну з пробіотиком, а також лазерного випромінювання з кальцитоніном і пробіотиком сприяло гармонійному репаративному остеогенезу, що підтверджується відповідною рентгенологічною картиною. Здатність B.animalis зменшувати інтенсивність системного запалення, а також модулювати всмоктування кальцію з кишечника і впливати на його метаболічні шляхи може бути передумовою досягнення повноцінної кісткової репарації.
Background. At the present stage, experimental studies and clinical observations are continuing to develop new treatment methods for improvement of bone fracture healing. In the era of increasing incidence of primary malignant and metastatic bone tumors, as well as in times of traumatic epidemics during the war, studying the possibilities of influencing the course of bone repair in order to accelerate or improve it is a justified direction of experimental research. Objective: to study the influence of modulating factors — infrared laser radiation, calcitonin and probiotic based on Bifidobacterium animalis — on the healing of a bone defect in an in vivo experiment. Materials and methods. Reparative osteogenesis was studied in 32 animals (Wistar rats) whose tibia were injured with a dental drill using ketamine anesthesia. The influence of modulating factors on the formation of bone callus was assessed by studying the injured limbs of animals using the Toshiba Radrex X-ray diagnostic system, with a power of 80 kW, a radiation dose during digital radiography of 0.03 mSv, ventrodorsal positioning (on the stomach, back up), as well as right lateral (side views). Results. The study showed that the formation of bone callus under the influence of the laser is active, but nonlinear and not always symmetrical, which is in line with the results obtained in other studies. Instead, this work for the first time paid attention to the study of the combined effect of several modulating factors on reparative osteogenesis, namely laser irradiation, calcitonin and probiotic. It should be noted that we observed the maximum stimulating effect on the formation of bone callus in experimental animals in the laser + calcitonin group, which can even be characterized as excessive reparative activity of bone tissue. On the other hand, in the groups where a probiotic was present, reparative osteogenesis in rats proceeded more harmoniously, demonstrating better radiological results, such as in the calcitonin + probiotic group and especially in the group where the B.animalis preparation was combined with laser and calcitonin administration. It can be reasonably assumed that the inherent ability of B.animalis to normalize calcium metabolism creates conditions for reparative osteogenesis, as close as possible to the physiological scenario. Conclusions. The combination of calcitonin with a probiotic, as well as laser irradiation with calcitonin and a probiotic promoted harmonious reparative osteogenesis, which is confirmed by the corresponding radiological picture. The ability of B.animalis to reduce the intensity of systemic inflammation, to modulate calcium absorption from the intestine and influence its metabolic pathways may be a prerequisite for achieving complete bone repair.
травматичнi та онколітичні ушкодження кісток; переломи; репаративний остеогенез; кісткова мозоль; інфрачервоне лазерне випромінювання; кальцитонін; Bifidobacterium animalis; кальцій; рентгенограма
traumatic and oncolytic bone injuries; fractures; reparative osteogenesis; bone callus; infrared laser radiation; calcitonin; Bifidobacterium animalis; calcium; radiograph